4月17日,加科思药业官微发布消息称,其自主研发的KRAS G12C抑制剂glecirasib胰腺癌适应症被美国食品药品监督管理局(FDA)授予了孤儿药资格认定。此前,glecirasib已被CDE(国家药品监督管理局药品审评中心)授予用于KRAS G12C突变的二线或以上胰腺癌患者治疗的突破性治疗药物认定。
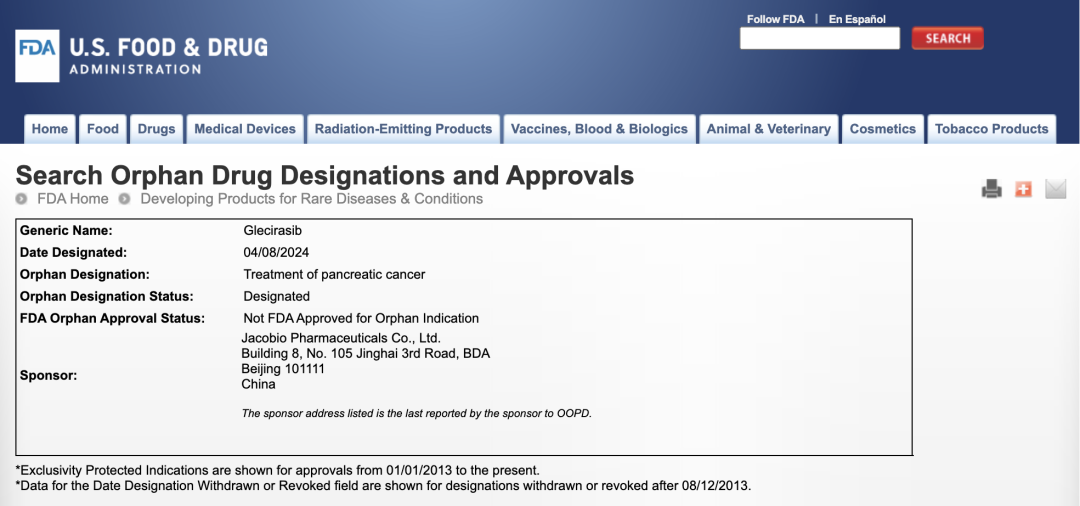
图片来源:FDA
胰腺癌是一种恶性程度极高的肿瘤,目前患者缺少有效的标准治疗手段,晚期胰腺癌五年总生存率仅为3.1%。孤儿药认定将有助于glecirasib的加速审评、注册及加快患者提早获得药物。
加科思此前在2024年美国临床肿瘤学会胃肠癌研讨会年会(2024 ASCO GI)以口头报告形式公布了二线及以上的KRAS G12C突变胰腺癌患者数据,确认客观缓解率为41.9%(13/31),疾病控制率为93.5%(29/31),中位无进展生存期(mPFS)为5.6个月,中位总生存期(mOS)为10.7个月。
加科思将持续探索glecirasib在KRAS G12C突变的胰腺癌领域等实体瘤的应用。glecirasib于2023年7月获得CDE批准开展胰腺癌注册性临床研究,是全球首 个获批开展胰腺癌注册性临床研究的同靶点项目,该研究的最终结果将用于胰腺癌适应症的上市申请。
戈来雷塞(JAB-21822)是加科思自主研发的KRAS G12C抑制剂。加科思目前已在中国、美国及欧洲多国启动多项针对晚期实体瘤患者的Ⅰ /Ⅱ期临床试验,包括在中国非小细胞肺癌关键性临床试验(已完成患者入组), 作为一线疗法单药治疗STK11共突变非小细胞肺癌,与SHP2抑制剂JAB-3312联用治疗非小细胞肺癌,戈来雷塞与西妥昔单抗在结直肠癌的联合用药,以及单药治疗胰腺癌的注册性临床研究。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57