全球药物批准/研发动态
01
全球新药批准情况
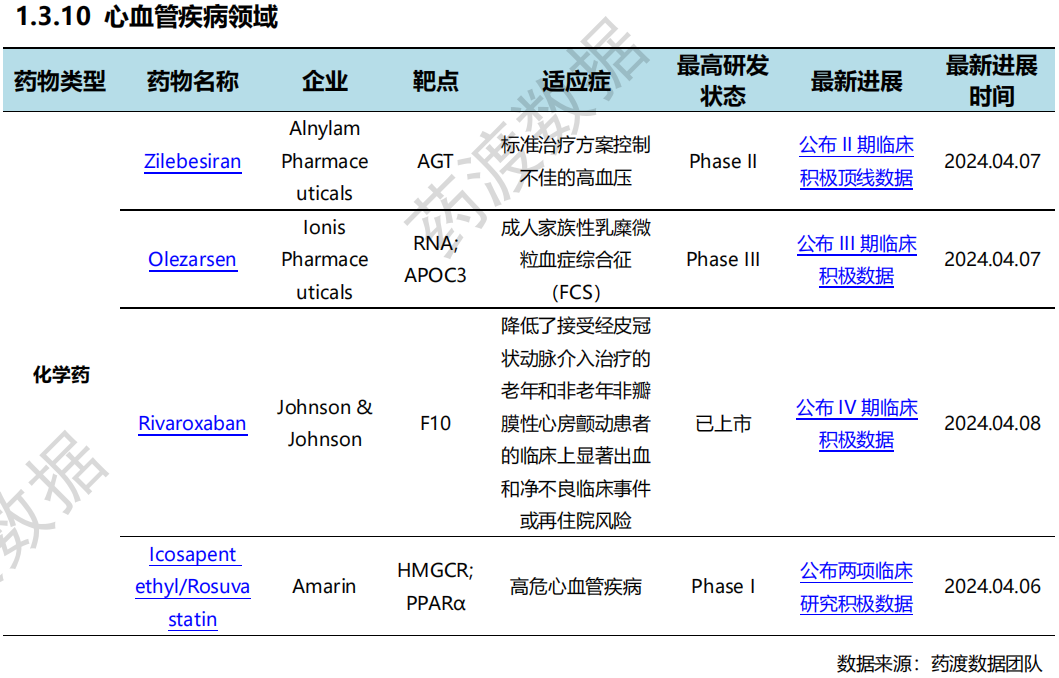
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)全球(不含中国)共有4个新药获批上市。其中,BLA批准1个,新适应症批准3个。与上个统计周期相比,本次减少2个批准新药。
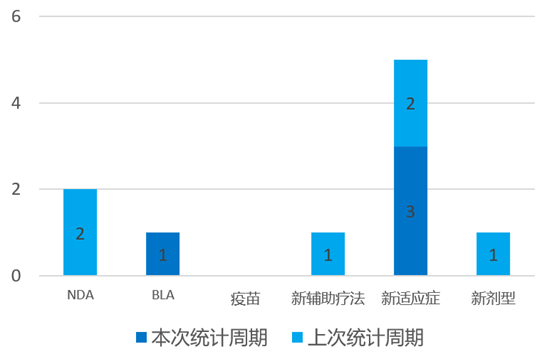
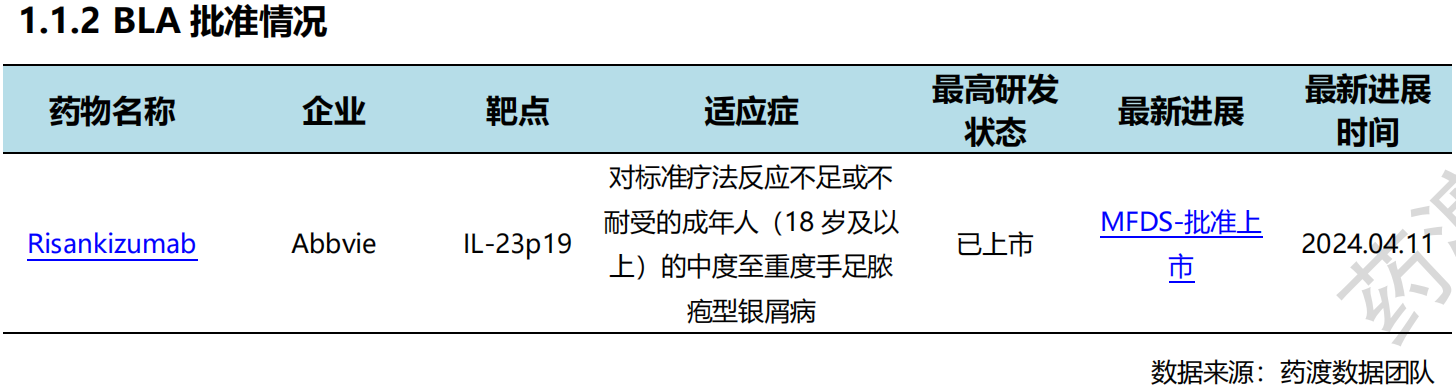
4月11日,艾伯维(AbbVie)银屑病治疗药物Skyrizi(Risankizumab)获MFDS的批准,用于治疗对标准疗法反应不足或不耐受的成年人(18岁及以上)的中度至重度手足脓疱型银屑病。作为一种维持疗法,Skyrizi在牛皮癣患者中表现出高度的皮肤改善和持续改善,每12周给药一次150毫克剂量,每年四次。Skyrizi在中度至重度斑块状银屑病和银屑病关节炎中显示出显著疗效,将为手掌脓包病患者提供新的治疗选择。
4月11日,AstraZeneca的Fasenra®(Benralizumab)获得FDA批准,用于治疗6至11岁嗜酸性粒细胞表型严重哮喘患者的附加维持治疗。Benralizumab于2017年首次被批准作为治疗12岁及以上严重嗜酸性粒细胞性哮喘(SEA)的附加维持治疗。Benralizumab的这一额外适应症得到了TATE的证据支持:Benralizumab达到了主要终点,证明6至11岁SEA儿童的药代动力学(PK)和药效学(PD)与先前试验中观察到的一致。Benralizumab目前在美国被批准作为6岁及以上SEA患者的附加维持治疗。
全球(不含中国)新药批准情况(部分)

02
全球新药申报进展
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)全球(不含中国)共有2个新药申报上市。其中,NDA申报进展2个。与上次统计周期相比,本次减少2个NDA/BLA申报。
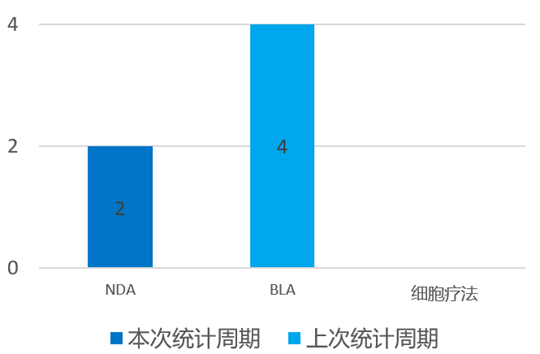
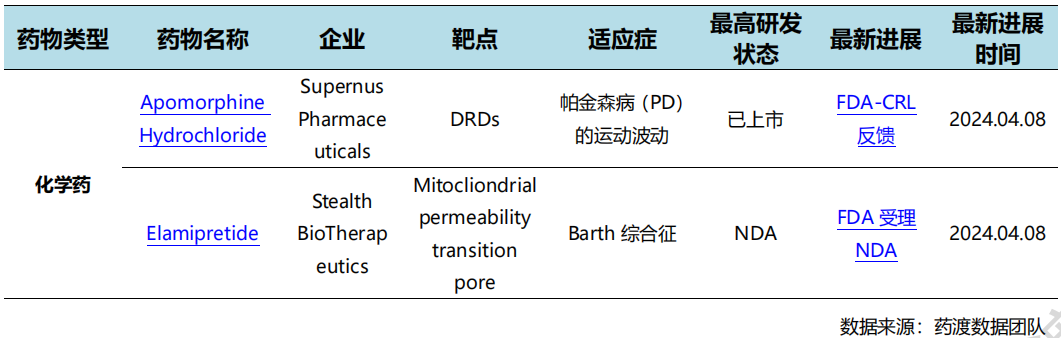
4月8日,Stealth宣布FDA接受Elamipretide用于治疗Barth综合征的新药申请。该NDA得到了SPIBA-001 III期自然病程对照研究的积极数据和TAZPOWER第2部分基线对照试验的额外支持疗效和安全性数据的支持。Elamipretide于2017年获得快速通道资格认定,2018年获得孤儿药资格认定,2020年获得罕见儿科疾病认定。
NDA/BLA申报情况
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)全球(不含中国)共有9个药物获监管机构特殊资格认定。其中,化学药5个,生物药4个。与上次统计周期相比,本次增加8个获监管机构特殊资格认定的药物。
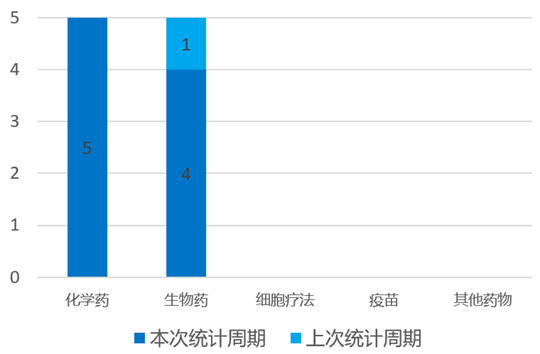
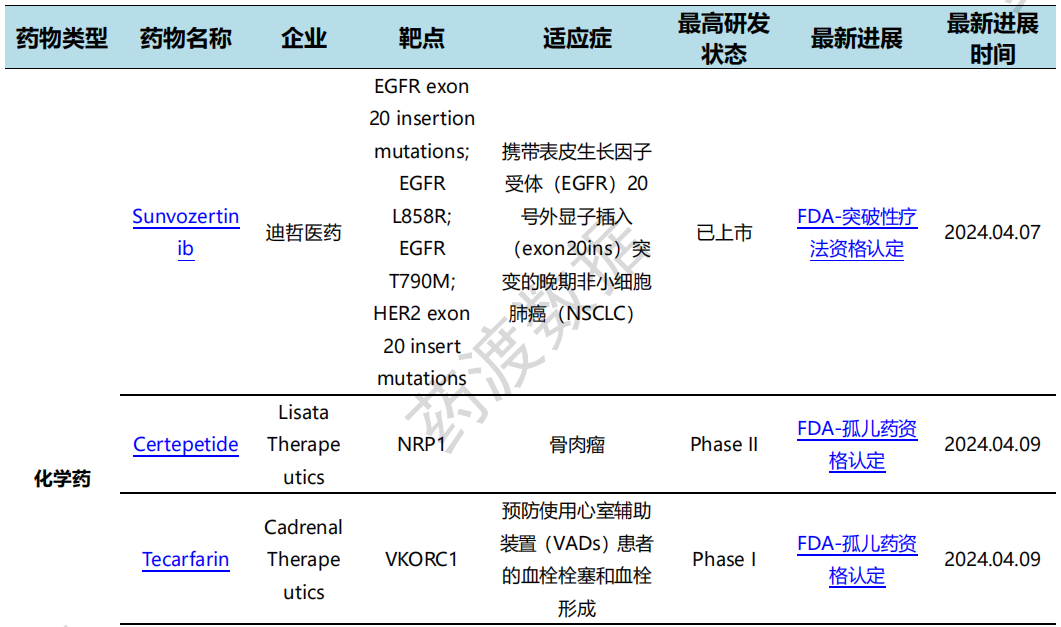
4月7日,迪哲医药宣布FDA授予其首 款自主研发的新型肺癌靶向药舒沃哲®突破性疗法认定,用于一线治疗携带表皮生长因子受体(EGFR)20号外显子插入(exon20ins)突变的晚期非小细胞肺癌(NSCLC)患者。舒沃哲®于2023年8月在中国通过优先审评首 发上市是目前全球唯一获批针对EGFR exon20ins突变型晚期NSCLC的小分子TKI。
4月9日,同宜医药宣布自主研发的第二代Bi-XDC双配体偶联药物CBP-1019已经获得FDA孤儿药资格认定,用于治疗食管癌。这是CBP-1019继去年9月获得FDA孤儿药资格认定用于治疗胰腺癌后的又一次认可。连续获得两个适应症的孤儿药资格认定将有助于CBP-1019在美国的注册申报、临床开展及商业化进程加速推进。
特殊资格认定情况(部分)
03
全球新药研发进展
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)全球(不含中国)新药临床研发状态更新共计54条,涉及肿瘤、血液和淋巴疾病、遗传代谢病、精神疾病、皮肤病以及眼部疾病等共计11个领域。
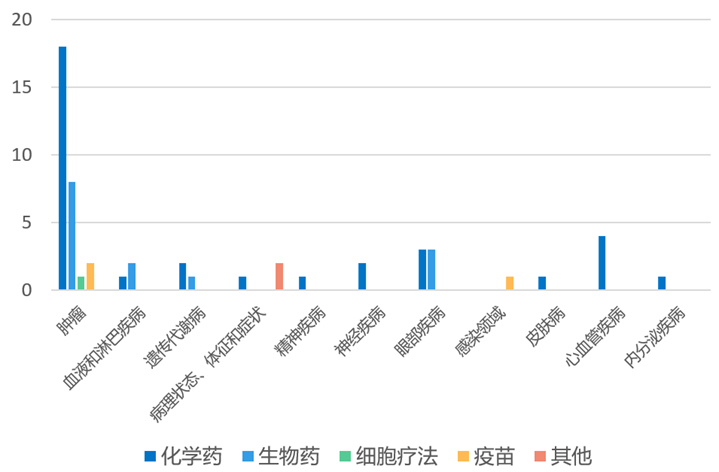
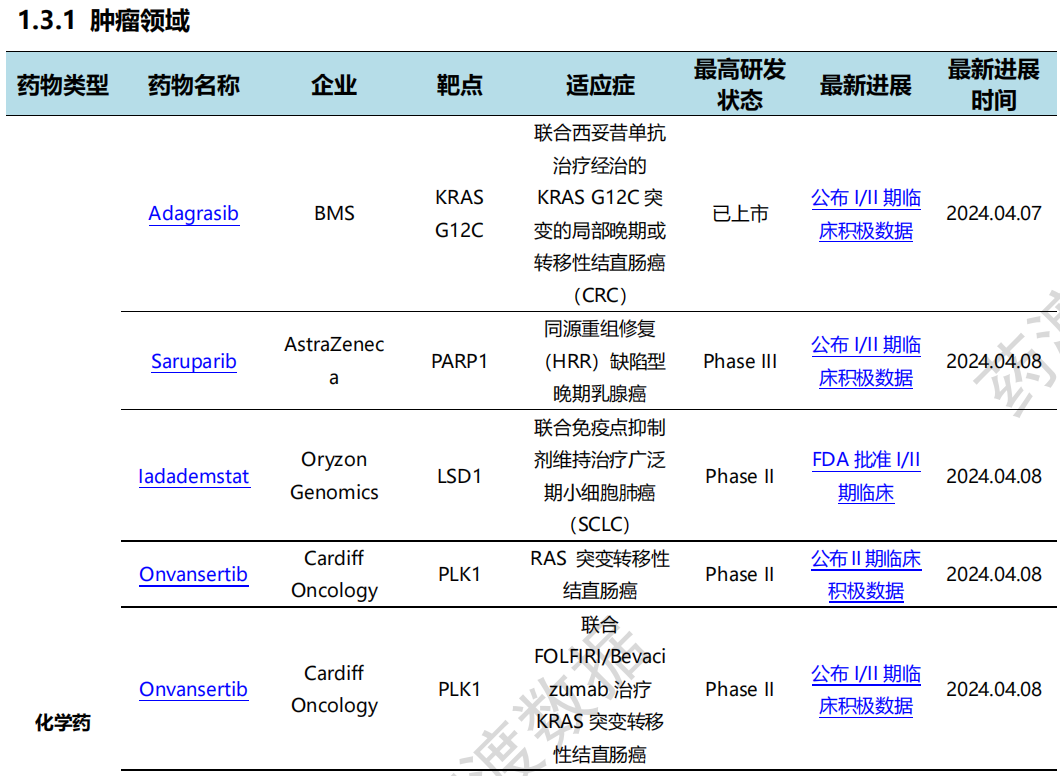
其中,肿瘤领域临床进展更新居各领域之首,涉及化学药18条,生物药8条,细胞疗法1条,疫苗2条。
4月8日,三叶草生物公布其二价RSV候选疫苗SCB-1019 I期临床试验首批年轻成年人群组获得积极初步数据:SCB-1019诱导的RSV-A和RSV-B中和滴度水平显著提高,分别达到约6,600 IU/mL(提高6.4倍)和约46,000IU/mL(提高12倍)。老年人群入组I期临床试验也已顺利如期推进,初步数据将于2024年下半年公布。
4月12日,药捷安康宣布在2024年AACR上公开Tinengotinib针对携带FGFR1-3变异晚期泛实体瘤(单药)的最新研究成果并入选突破性研究。Tinengotinib针对多种癌症都有疗效信号,包括胆管癌、乳腺癌、前列腺癌、尿路上皮癌、结肠癌及头颈癌,疗效为BOR 33.3%,DCR 88.2%,mPFS 6.90个月。Tinengotinib已获得FDA孤儿药认证及快速通道资格认证, EMA孤儿药认证;NMPA批准纳入突破性治疗品种名单。
全球新药研发进展详情(部分)
04
全球医药交易事件
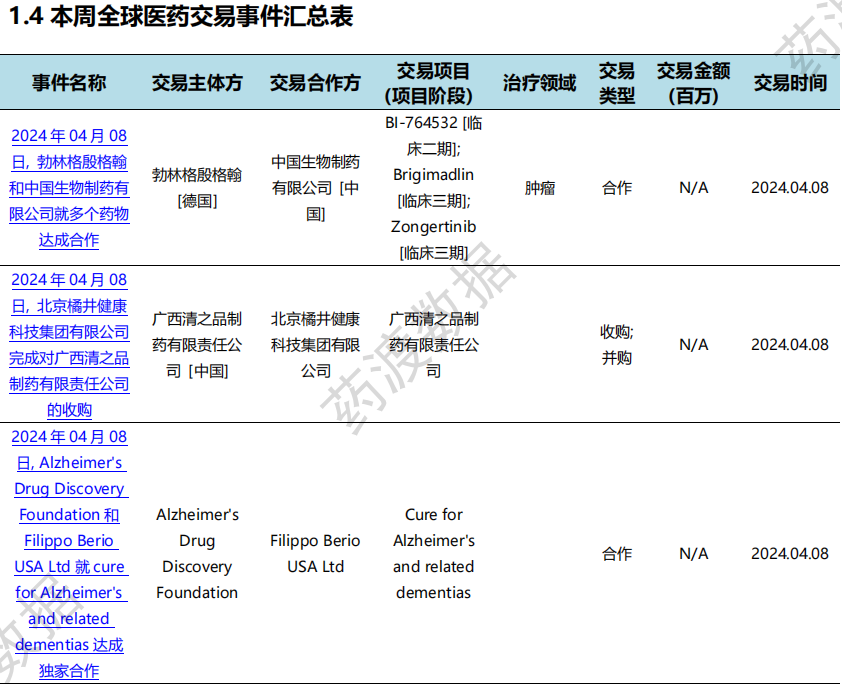
本次统计周期(2024.04.06-04.12)全球(含中国)医药交易时间共计21起,涉及药物权益转让、公司并购等多起交易事件。
全球医药交易时间汇总表(部分)
国内药物批准/研发动态
01
国内新药批准情况
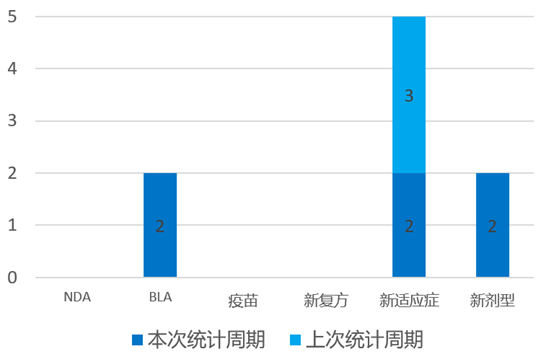
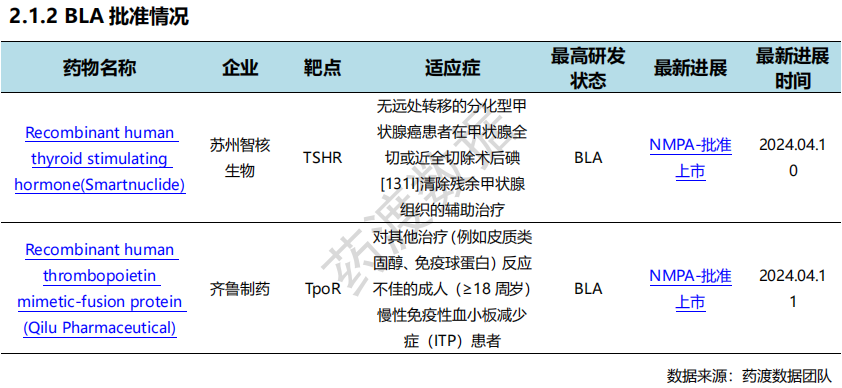
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)国内共有6个新药获NMPA批准上市。其中,BLA批准2个,新适应症批准2个,新剂型批准2个。与上次统计周期相比,本次增加3个NMPA批准新药。
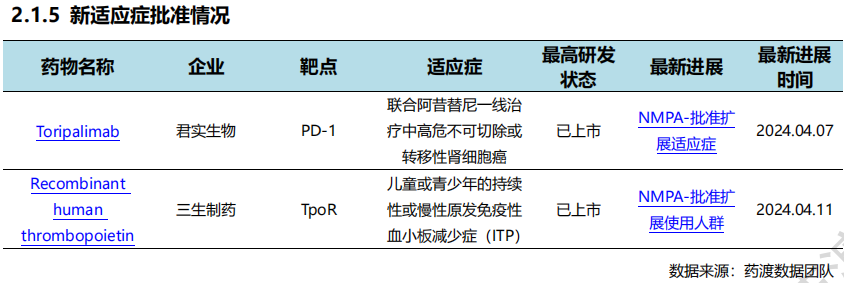
4月7日,君实生物宣布,由公司自主研发的抗PD-1单抗药物特瑞普利单抗注射液(拓益®)联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗新适应症上市申请于近日获得NMPA批准。这是特瑞普利单抗在中国获批的第八项适应症,也是我国首 个获批的肾癌免疫疗法。此次新适应症的获批主要基于RENOTORCH研究(NCT04394975)的数据结果,这是我国首 个晚期肾癌免疫治疗的关键III期临床研究。
4月11日,三生制药宣布NMPA已于4月2日批准重组人血小板生成素注射液(特比澳®)新适应症,用于治疗儿童或青少年的持续性或慢性原发免疫性血小板减少症(ITP)。此前特比澳®已获批成人实体瘤化疗后血小板减少症(CIT)和成人原发免疫性血小板减少症(ITP)适应症。目前,重组人血小板生成素注射液是中国ITP指南推荐首选的二线治疗药物。
中国新药批准情况(部分)
02
国内新药临床默示许可进展
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)国内共有38个新药获临床默示许可,涉及53个受理号。其中,化学药20个,治疗用生物制品18个。与上个统计周期相比,本次减少17个临床默示许可获批受理号。
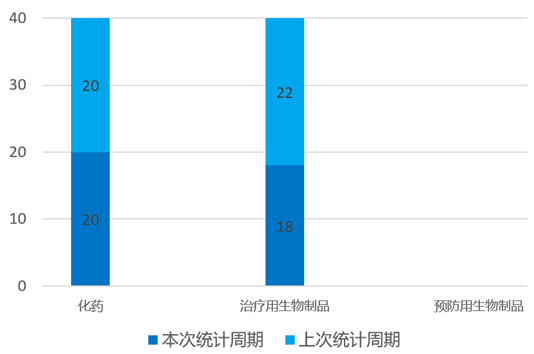
本周国内新药临床默示许可进展(部分)
03
国内新药申报进展
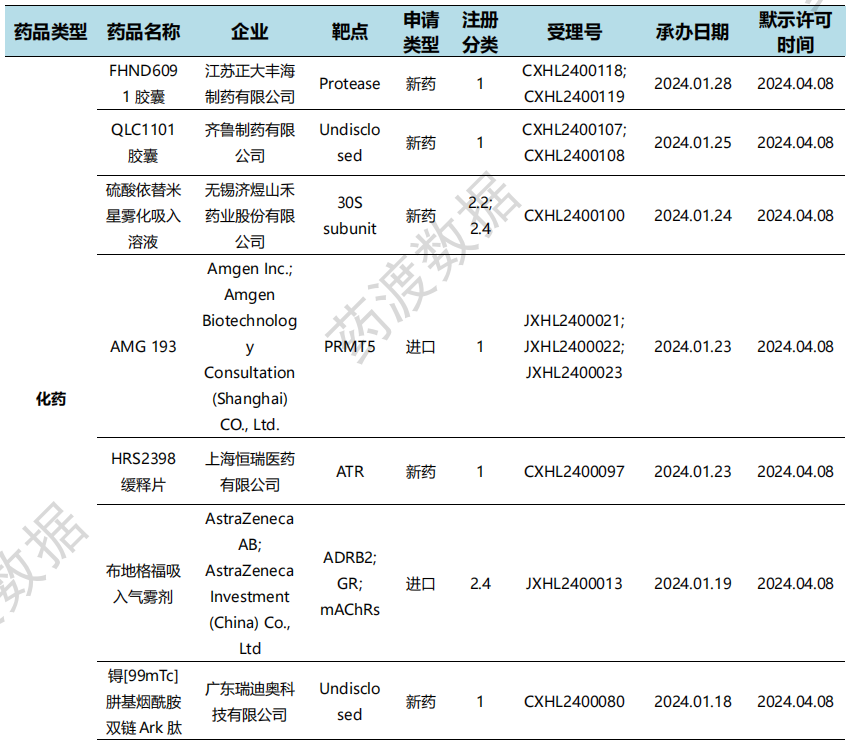
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)国内共有8个新药申报上市,涉及14个受理号。其中,化学药4个,治疗用生物制品3个,预防用生物制品1个。与上个统计周期相比,本次增加2个新药申报上市受理号。
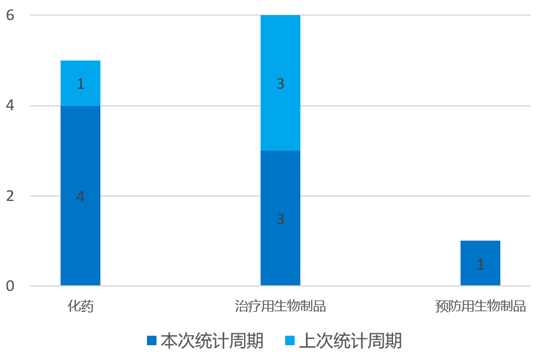
国内新药申报上市情况(部分)
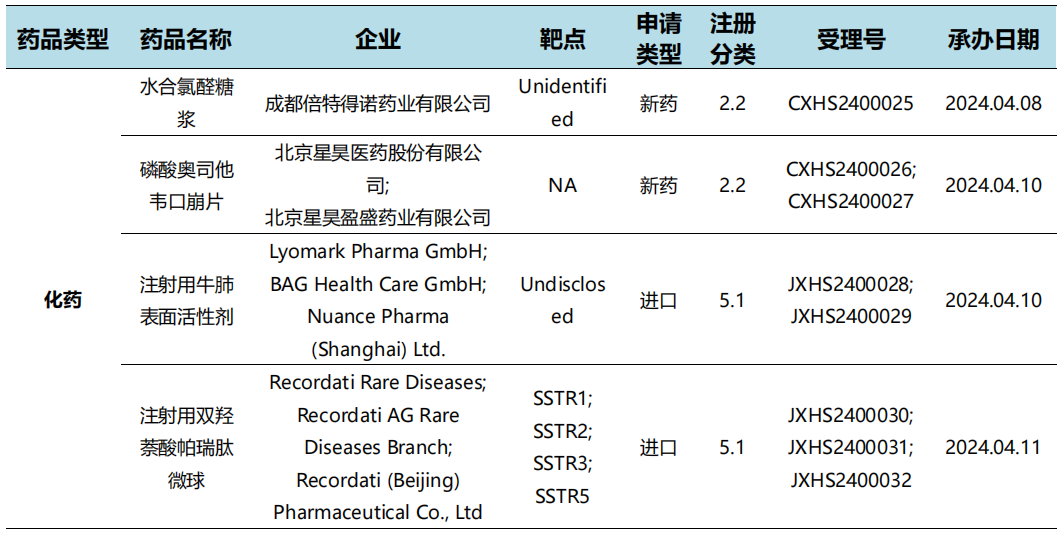
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)国内共有37个新药申报临床,涉及56个受理号。其中,化学药17个,治疗用生物制品19个,预防用生物制品1个。与上个统计周期相比,本次增加20个临床申报受理号。
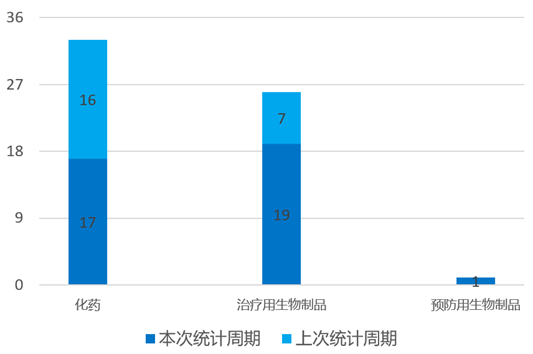
国内新药临床申报情况(部分)
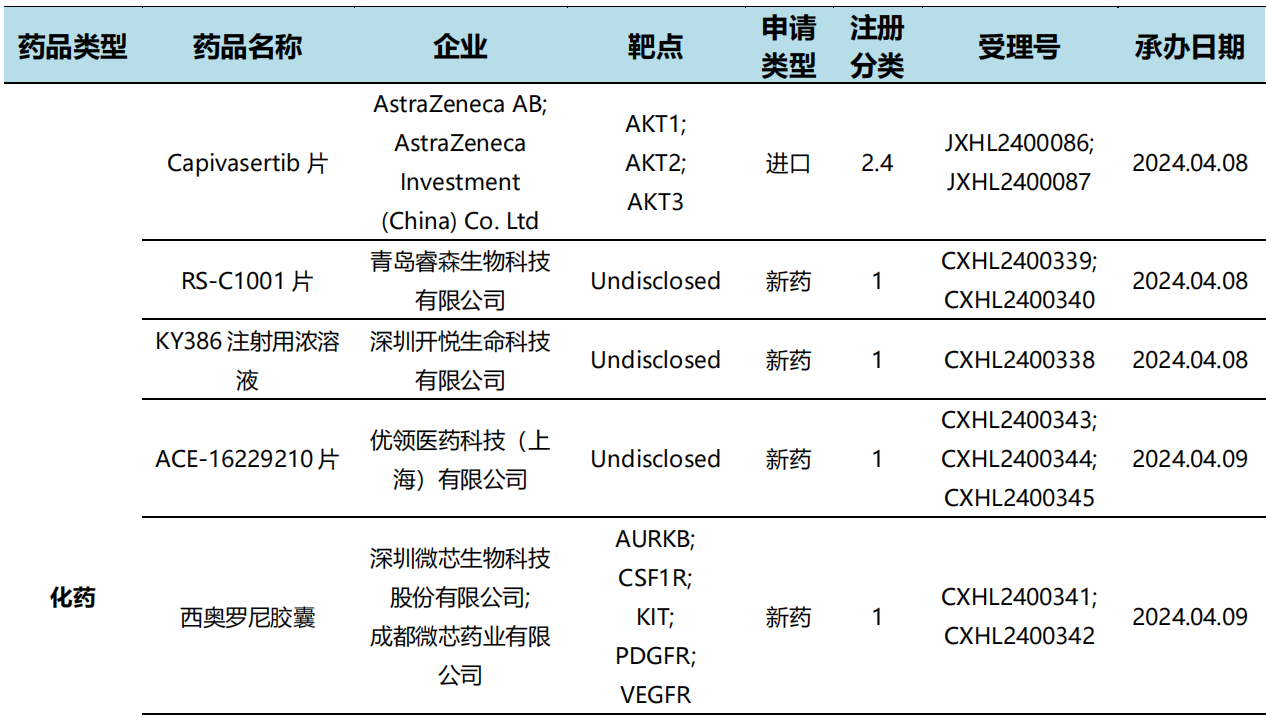
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)国内共有2个药物获NMPA特殊资格认定。其中,化学药1个,生物药1个。与上个统计周期相比,本次增加1个获监管机构特殊资格认定的药物。
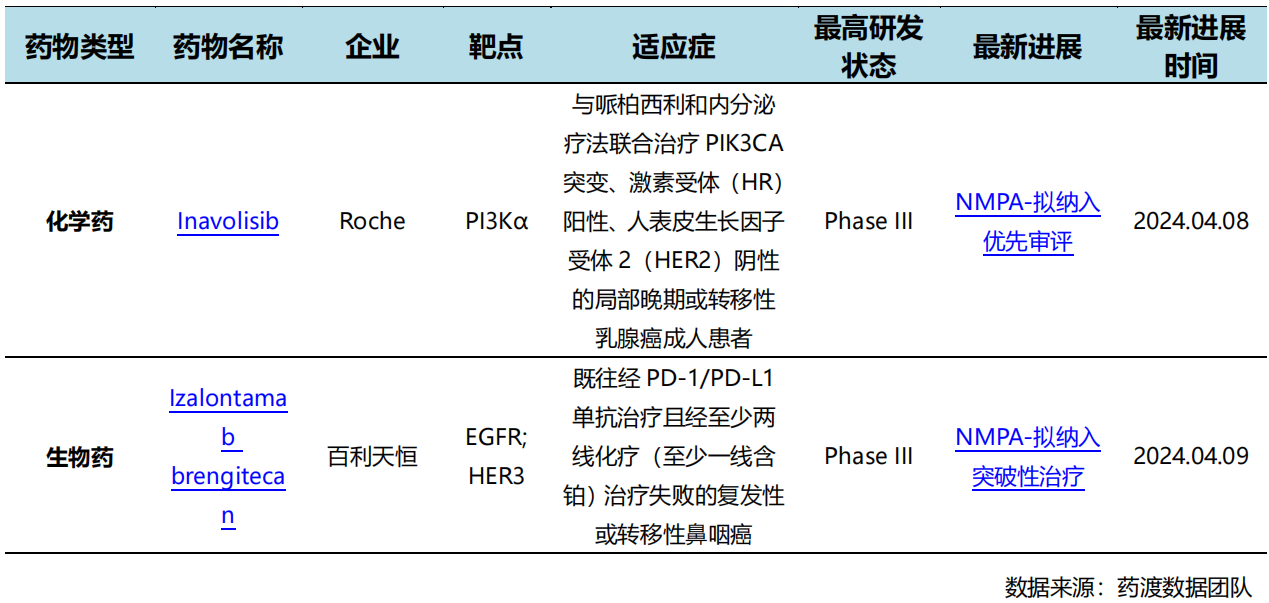
4月9日,中国国家药监局药品审评中心(CDE)官网公示,百利天恒申报的注射用BL-B01D1拟纳入突破性治疗品种,针对适应症为既往经PD-1/PD-L1单抗治疗且经至少两线化疗(至少一线含铂)治疗失败的复发性或转移性鼻咽癌患者。公开资料显示,BL-B01D1是一款EGFR×HER3双特异性抗体偶联药物(ADC)。该产品治疗鼻咽癌的III期临床研究目前正在进行中。
BL-B01D1是一种基于双特异性拓扑异构酶抑制剂的ADC,可同时靶向作用于表皮生长因子受体和人表皮生长因子受体3(EGFR×HER3),二者在大多数上皮性肿瘤中高度表达。BL-B01D1已经开展了多个I期临床研究。肿瘤评估数据显示,该产品已经在12种肿瘤中均有强烈的有效性信号,且在II期推荐剂量(RP2D)下具有良好的安全性。其中针对非小细胞肺癌及晚期或转移性鼻咽癌表现出突破性疗效。
NMPA特殊资格认定情况(部分)
04
国内新药研发进展
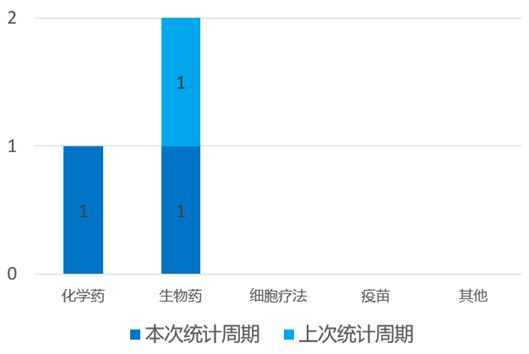
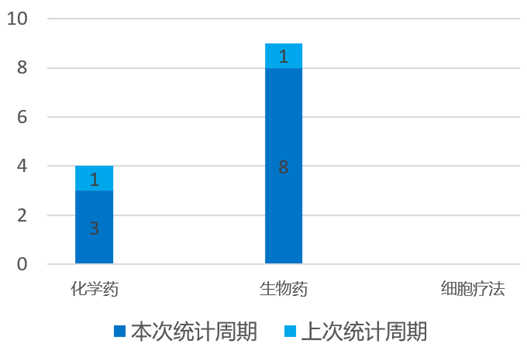
根据药渡数据统计分析,本次统计周期(2024.04.06-04.12)国内新药临床研发状态更新共计11条,涉及肿瘤、遗传代谢病和皮肤病等共计6个领域。其中,化学药3个,生物药8个。
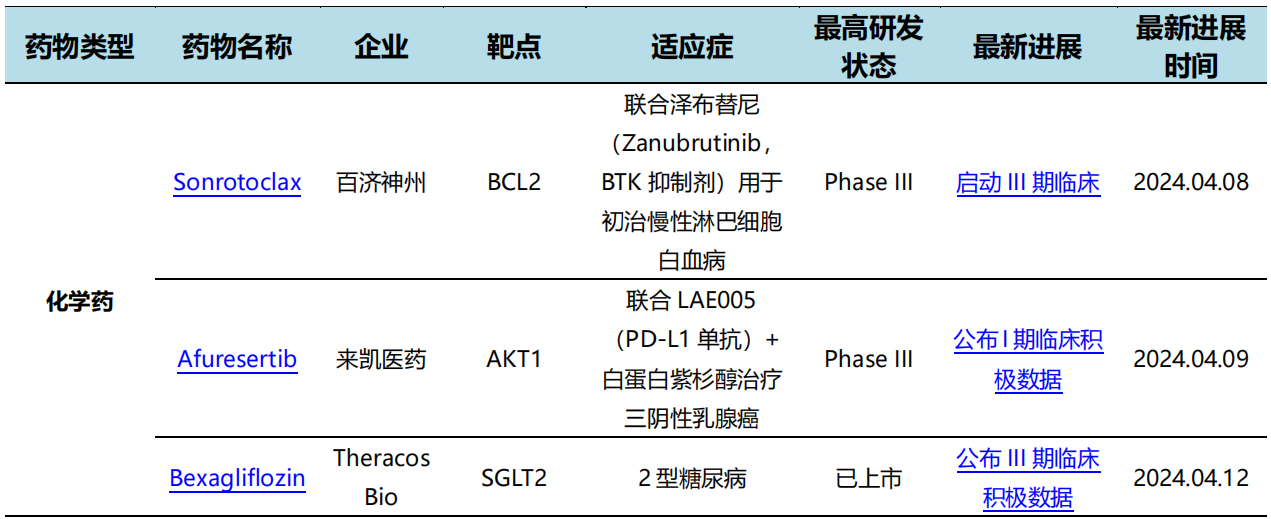
4月8日,康方生物研发的PD-1/CTLA-4双特异性抗体开坦尼®(卡度尼利单抗注射液)联合奥沙利铂和卡培他滨用于一线治疗不可手术切除的局部晚期复发或转移性胃或胃食管结合部(G/GEJ)腺癌的III期临床研究(AK104-302/COMPASSION-15)的期中分析阳性结果在2024年AACR上以口头报告(Oral)的形式重磅发布。
COMPASSION-15研究是全球首 个PD-1/CTLA-4双特异性抗体联合化疗一线治疗胃癌的III期临床研究。研究结果显示,卡度尼利联合方案对比化疗可大幅度延长患者的总生存获益和降低死亡风险,对于肿瘤治疗客观缓解和远期生存的获益非常突出。即使对于PD-L1低表达人群也具有同样优异的疗效,有望弥补当下PD-1单抗一线治疗PD-L1低表达胃癌疗效有限的短板,为晚期胃癌患者提供更为全面高效的免疫治疗方案。
国内新药研发进展情况(部分)
05
国内新药研发领域政策法规动态
本周无新药研发领域政策法规发布。
06
国内新药研发领域热点新闻
迈威生物,下一个Biotech盈利新星?
医药市场波谲云诡,无数Biotech企业都在试图从白热化的竞争中脱颖而出。然而,迈威生物却以半年涨幅高达150%,成为资本市场“最靓的仔”。
近日,迈威生物公布2023年财报:实现总营收1.28亿元,同比激增361.03%,再次被推至市场聚光灯下。
然而,面对激烈的市场竞争,迈威生物能否保持强劲的发展势头?其研发的创新药又能否成功‘出海’,成为公司扭亏为盈的关键?这些都是市场关注的焦点。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57