Alnylam迎来了一场胜利。
6月24日,Alnylam宣布其RNAi药物vutrisiran(Amvuttra)的III期顶线阳性结果——显著降低了转甲状腺素蛋白淀粉样(ATTR)心肌病患者的死亡或复发性心血管事件风险。Alnylam是小核酸领域的先锋者。2018年,FDA批准了首款siRNA药物patisiran,即来自Alnylam,获批适应症为ATTR多发性神经病。
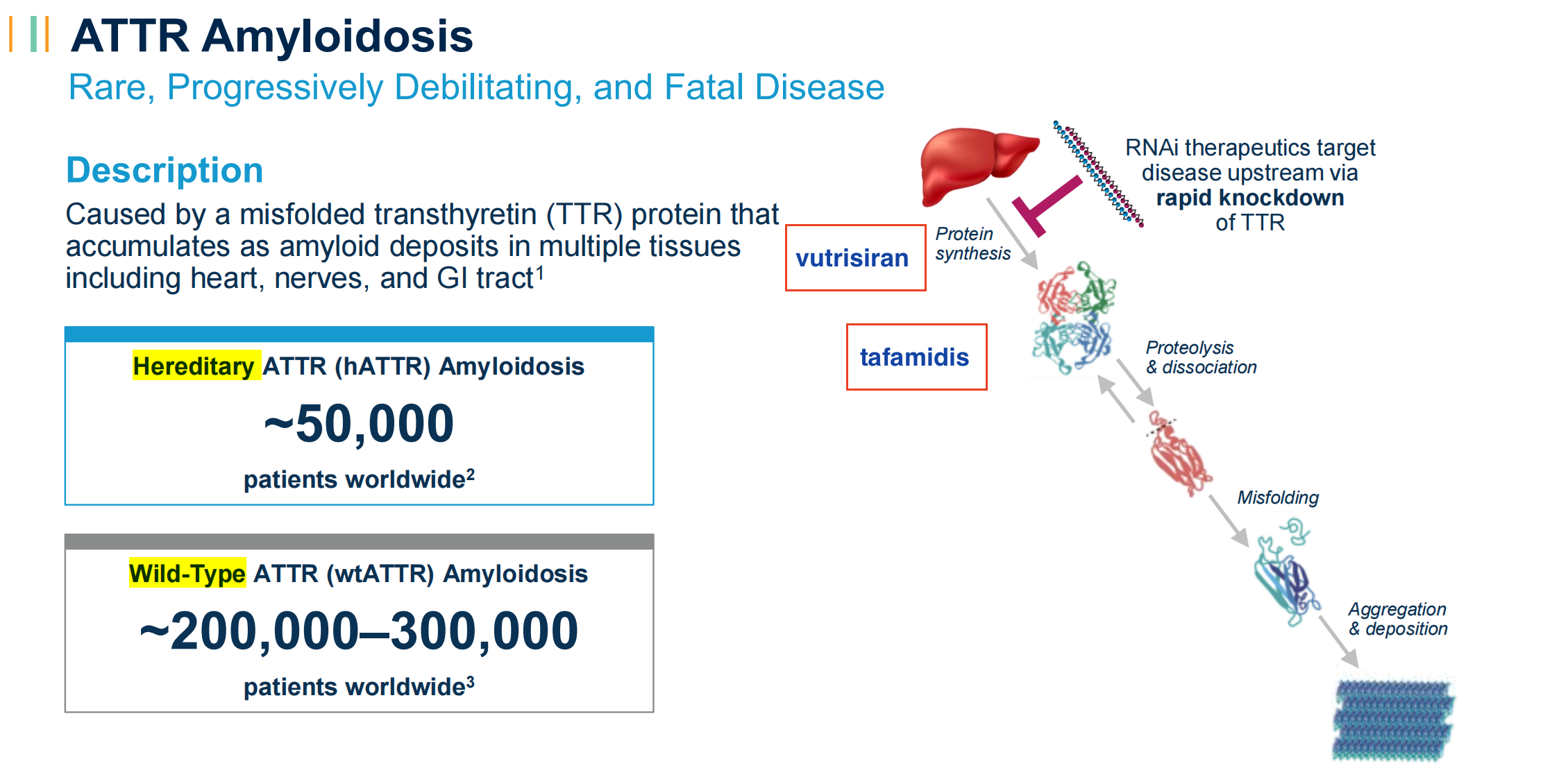
这一适应症,也是Alnylam在ATTR领域的根基——本次主角vutrisiran在随后的2022年获得FDA批准用于治疗ATTR多发性神经病。以此出发,将适应症扩展到ATTR心肌病,是Alnylam的野心。但正如大多数故事一样,开端总是以失败告终。patisiran理所当然成为第一个试验对象。但在APOLLO-B研究中,patisiran在全因死亡率和心血管事件频率等终点,并未获得相对安慰剂的显著改善。尽管心血管和肾脏药物咨询委员会以绝大多数票数支持patisiran的获益,但FDA最终并未给予其该适应的上市绿灯。
vutrisiran所在的HELIOS-B研究,让疗效讨论并无模糊空间——在ATTR心肌病患者中,达到了总人群和单药人群中的主要和所有次要终点。Alnylam相信vutrisiran将会成为ATTR心肌病的新的一线标准治疗。且该适应症的发病率相比ATTR多发性神经病要高近10倍,意味着市场将会更宽广。
参考维度来自当前ATTR心肌病的标准治疗tafamidis(辉瑞,首款)。这是一种口服转甲状腺素蛋白稳定剂,已获批ATTR引发的多发性神经病和心肌病两种适应症(均在中国上市),2023年全年销售额为33亿美元,同比增长36%。
“这是我们迈向全球领先biotech的重要转折点”,在电话会上,Alnylam声称。
挑战辉瑞,可以下几个角度可以拆解。
1)独特的作用机制
ATTR心肌病是一种罕见的致死性疾病,常与心衰相混淆。其发病机制在于不稳定甲状腺素蛋白的异常解离后的错误折叠,形成淀粉样物质沉积于心肌间质和身体其他部位。随着时间的推移,淀粉样物质沉积会使心肌变硬,进而引发心衰。由于疾病认知度低及临床症状特异性差等因素,ATTR心肌病经常会被误诊或延误诊治。患者临床诊断后平均存活时间较短,约为2-3.5年,死亡通常由进行性心力衰竭引起。
某种程度上,是比恶性肿瘤患者更糟的处境。辉瑞的tafamidis是一种转甲状腺素蛋白稳定剂,有效成分为氯苯唑酸。通过选择性与转甲状腺素蛋白结合,稳定其四聚体形式,从而减缓ATTR心肌病的淀粉样物质形成。Alnylam的vutrisiran则作用于上游,快速敲低肝脏上的转甲状腺素蛋白表达,从而降低致病蛋白的循环水平,减少在心脏的淀粉样蛋白沉积。
在ATTR多发性神经病领域,这两款药物已经率先验证了自己的治疗思路可行。比较特别是,Alnylam认为vutrisiran的RNA沉默机制可能会使治疗效果随着时间推移而增强。
2)临床数据支持一线应用
对于ATTR心肌病,病人和医生最关心什么?是死亡率。
辉瑞的tafamidis,在III期研究ATTR-ACT中(接受tafamidis治疗264人),相比安慰剂组,将全因死亡率和心血管相关住院率分别降低了30%和32%。在第30个月时,减少了6分钟步行测验分数和心肌病问卷(KCCQ-OS) 评分的下降。
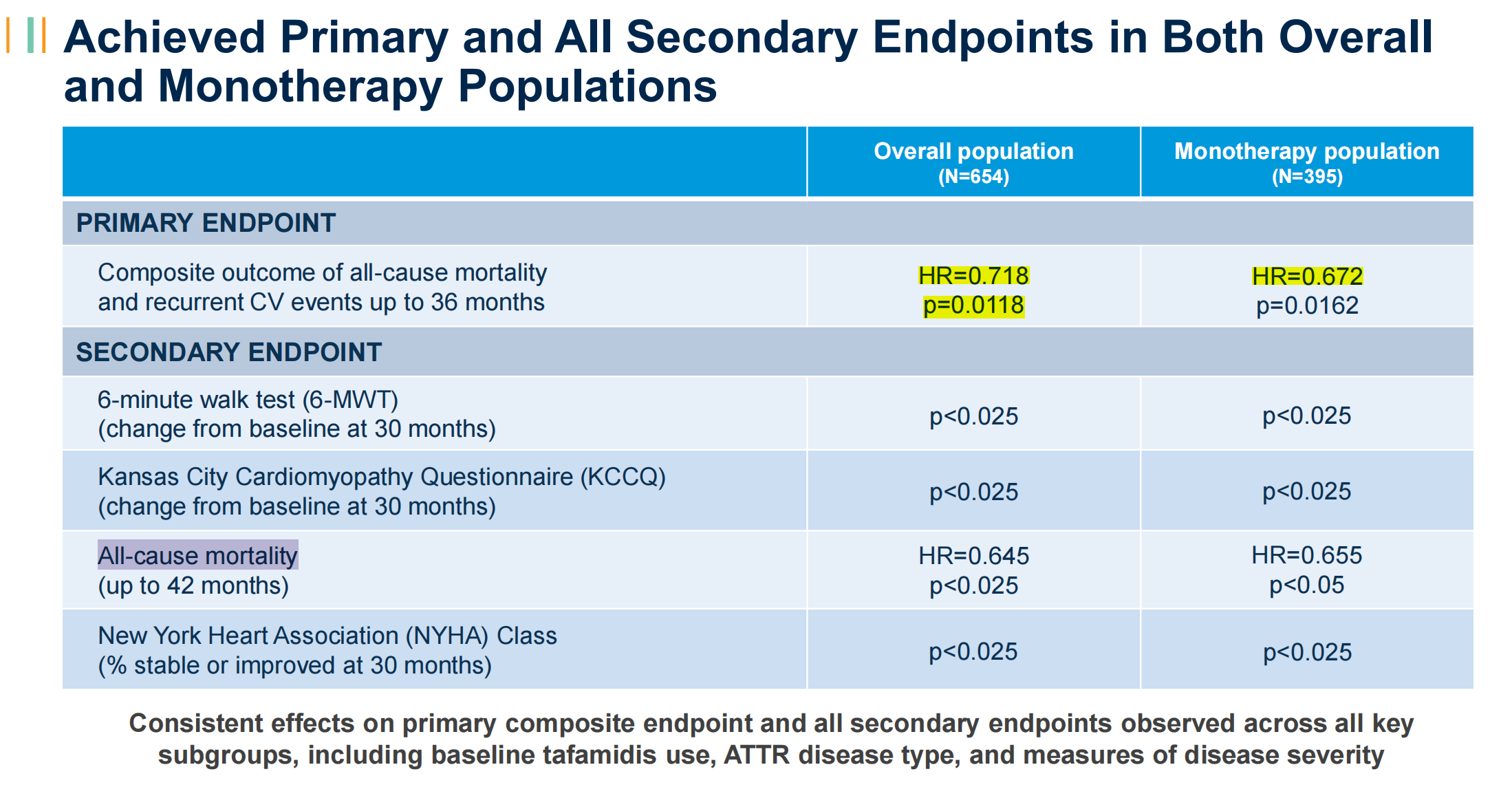
Alnylam的vutrisiran,III期研究中纳入了40%基线时接受tafamidis治疗的患者。安慰剂对照,主要复合终点为在至多36个月的全因死亡率和复发性CV事件。
结果显示:
·在总人群中(包括使用tafamidis,654人),相比安慰剂,vutrisiran将全因死亡率和复发性CV事件风险降低28%;
·单药人群中(仅使用vutrisiran,395人),相比安慰剂,vutrisiran将全因死亡率和复发性CV事件风险降低33%;
·至多42月时,总人群和单药人群中的全因死亡率分别降低35%和34%;
相差无几的死亡率降低,给予vutrisiran直接竞争的自信。此外,在6分钟步行测验分数和 KCCQ-OS评分方面,vutrisiran也做到了显著的改善。
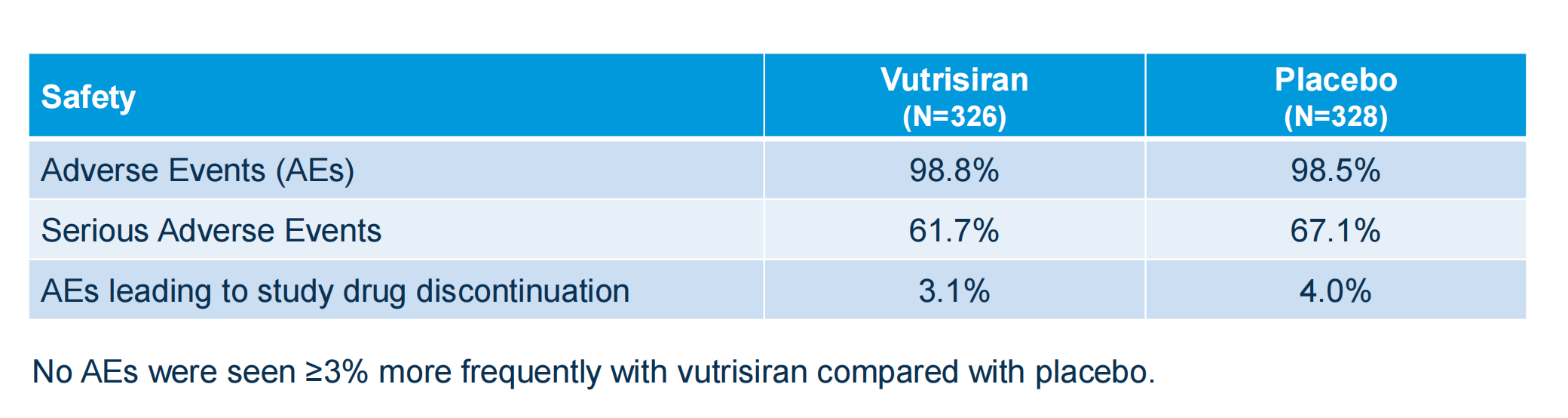
在安全性方面,vutrisiran与安慰剂表现相平衡。tafamidis与安慰剂表现也同样均衡。
3)剂型差异
tafamidis是口服剂型。它有两种名称,分别为Vyndaqel和 Vyndamax,区别在于所含tafamidis形式不同,前者含有微粉化葡甲胺盐,后者含有游离酸形式。简而言之,tafamidis需要日服一次,只不过Vyndaqel需要一次4粒胶囊,Vyndamax一次1粒胶囊。
vutrisiran是皮下注射剂,季度给药,即1年4剂。一般情况,口服药物的依从性会高于注射液,但长效注射剂又带来了另外的依从性附加值。
4)更进一步?联合用药
在HELIOS-B研究中,总人群包括40%既往使用tafamidis的患者,所以由此带来的一个很显然的问题:tafamidis+vutrisiran的组合效果如何?Alnylam没有透露联用的具体数据,因为该试验的目的并非是评估联用效果。而从已披露数据来看,总人群的全因死亡率终点的效应值和P值略好于单药组。
但从价格的角度来看,是否有联用的必要性?
罕见病没有便宜药。61mg Vyndamax的定价(30粒胶囊)价格为2.35美元,差不多年治疗费用近30万美元,在没有任何折扣报销之前。而vutrisiran在ATTR多发性神经病适应症上的年费用为46.35万美元。由于作用机制不同,tafamidis+vutrisiran具有联用可能性,并且在研究中也得到了初步的附加获益验证。但如果只是为了微薄的附加获益,却要支付高一倍的费用,在真实世界中,会有多少患者愿意买单?
或许这就是在电话会议中,当分析师多次询问联用效果时,Alnylam未能直面明确回答的原因。
短期内,ATTR心肌病的治疗格局仍然是单药、长期治疗。

5)商业化:这个适应症意味着什么?
Alnylam估算,ATTR心肌病的患病率是ATTR多发性神经病的10倍。2023年,vutrisiran凭周围神经病适应症,销售额达到5.58亿美元。
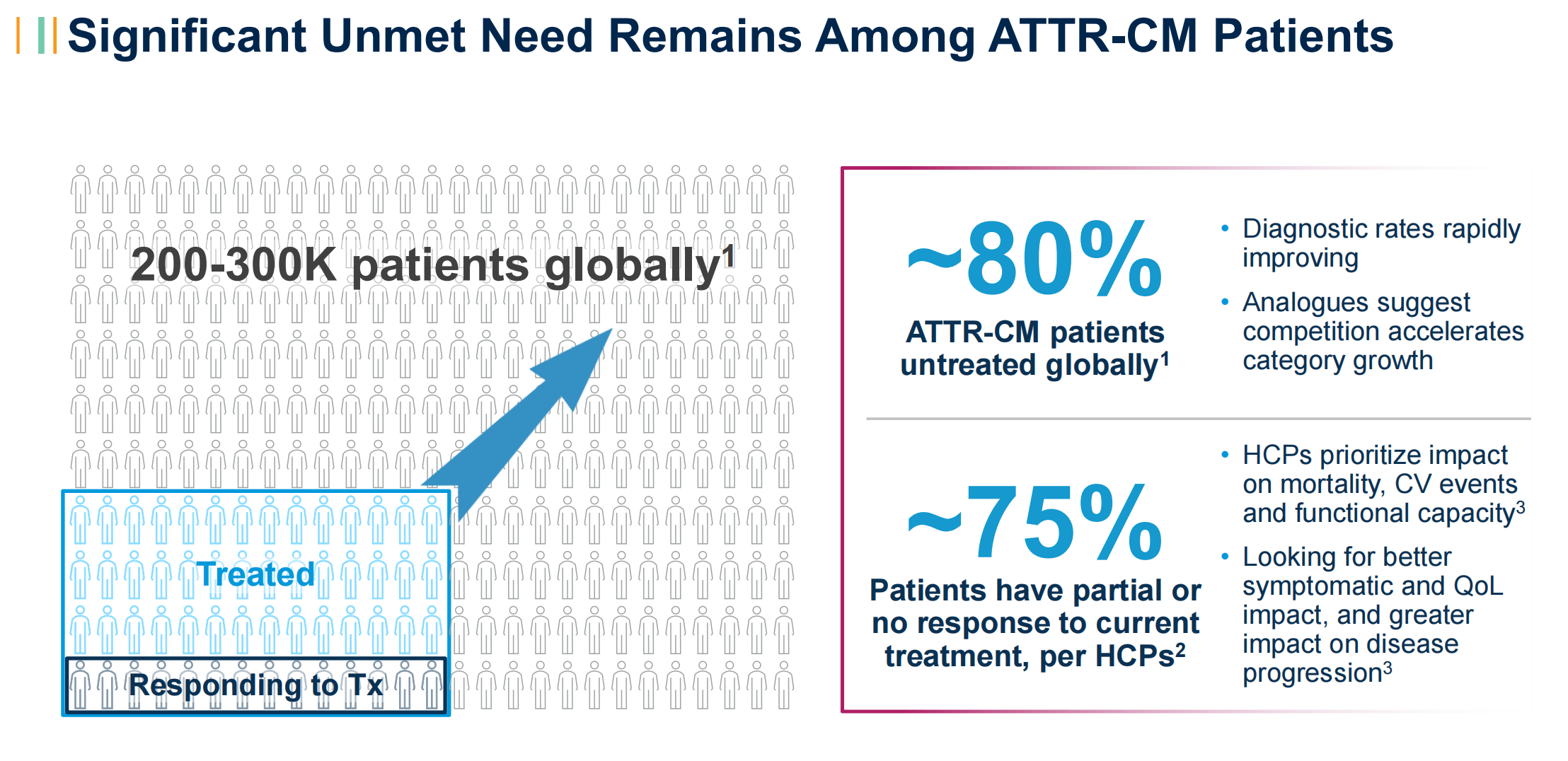
在目前所估算的20万-30万名ATTR心肌病患者中,仍有80%患者未得到治疗。不过随着诊断率的提升,治疗率也将随着提升。一句题外话,辉瑞的tafamidis于2020年9月在中国获得ATTR心肌病上市许可。在当时的新闻稿中,提及到中国ATTR心肌病诊断率极低,不足1%。这也是罕见病的另外一个伴生门槛,对于医生资源、诊断水平的要求。
凭借两款TTR药物patisiran和vutrisiran,Alnylam已经在ATTR多发性神经病市场上占有90%份额,建立起相关市场推广的基础能力。
在Alnylam的市场调研中,发现在目前接受可用治疗选择的ATTR心肌病患者中,近3/4只经历了部分缓解或无响应。这意味着,功能能力和生活质量的不可避免下降,住院治疗,以及死亡。对于新疗法的需求,仍然迫切。显著的死亡率降低获益,Alnylam认为是令人信服的证据,可帮助患者转化。
根据早些年Evaluate Vantage的评估,vutrisiran在2026年可能会达到18亿美元年销售额。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57