近日,强生公司公布了nipocalimab在3 期 Vivacity-MG3 研究中的积极结果;数据显示,在全身性重症肌无力 (gMG) 患者中,以 24 周内 MG-ADL 评分从基线改善为主要终点,nipocalimab与标准治疗 (SOC) 联用的患者疗效优于安慰剂加 SOC。无独有偶,公司还于近期宣布,nipocalimab在一项针对成人干燥综合征(SjD)患者的2 期临床试验DAHLIAS中达到试验主要终点;数据显示,接受nipocalimab 治疗的患者在第24 周与基线相比,其ClinESSDAIa 评分显示出统计学显著(P=0.002)和具有临床意义的改善。
Nipocalimab 是一款潜在“同类最佳”靶向FcRn的抗体疗法,此前已获得FDA授予的突破性疗法认定。2020 年8 月,强生以65 亿美元收购生物技术公司Momenta,获得3期药物nipocalimab,加强自身免疫病管线的布局。公司将在2024年欧洲神经病学学会 (EAN)大会上展示nipocalimab的详细数据,并将于今年晚些时候提交相关数据给监管机构。
一、关于FcRn
FcRn 又称Brambell受体,是一种由Fcgrt 基因编码的非典型的Fcγ 受体(FcγRs)。FcγRs 对免疫球蛋白(IgG)的识别代表了一种重要的免疫调节方式,即能够不IgG 上保守的Fc 结构域相结合,再以IgG免疫复合物(IgG IC)的形式递送独特的抗原决定簇。这些抗原决定簇被装载到I 类和II 类MHC 分子上,随后刺激相关CD8+和CD4+ T 细胞。IgG主要由脾脏以及淋巴结中的浆细胞合成和分泌,常以单体形式存在,是血清中最主要的抗体成分。在大多数体液免疫过程中,无论是针对病毒还是细胞病原体的保护作用也都涉及IgG 所介导的效应子功能。IgG能够清除侵入人体的外源异物,FcRn则在人体内用于维持IgG水平,增长IgG抗体半衰期,减缓IgG在溶酶体中的降解速度。
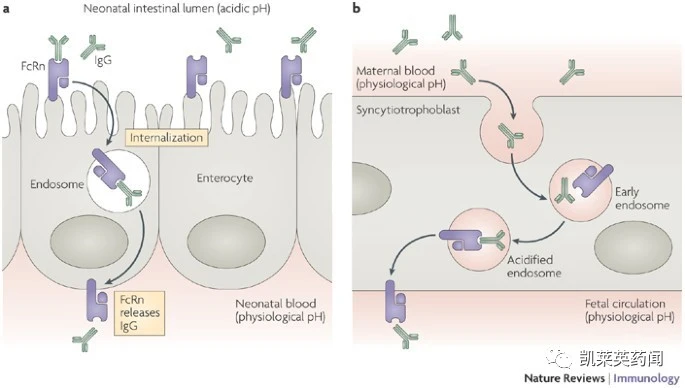
研究表明,FcRn 广泛表达于各个组织的细胞中,其中包括与血管壁对齐的内皮细胞,肠上皮细胞、气道上皮细胞、胎盘合胞体滋养细胞、肝细胞、内皮细胞、髓样细胞以及支气管导管细胞等;此外,在造血细胞如B 细胞、巨噬细胞以及树突状细胞中也収现了高水平表达的FcRn,理论上可导致七八十种自身免疫性疾病。由FcRn 介导的抗原递呈过程不能影响各个部位的稳态免疫激活,是内源抗肿瘤活性及肿瘤免疫监视系统中的重要组成部分,该过程已被广泛认可的CD8+ T 细胞能够抗肿瘤方面的重要性相一致, 因此FcRn 介导的交叉递呈也能够启动肿瘤保护的机制。
二、交易详情
据不完全统计,围绕FcRn开展相关交易近9笔,除强生收购Momenta的nipocalimab外,其它交易主要围绕巴托利单抗、efgartigimod(艾加莫德)以及tifalibep(替法利贝普)等药物开展。

三、最新研究进展
据不完全统计,目前全球在研的FcRn药物约16种,种类包括以单克隆抗体为主;已获批的适应症主要包括重症肌无力、慢性炎症性脱髓鞘性多发性神经病、原发免疫性血小板减少症等。
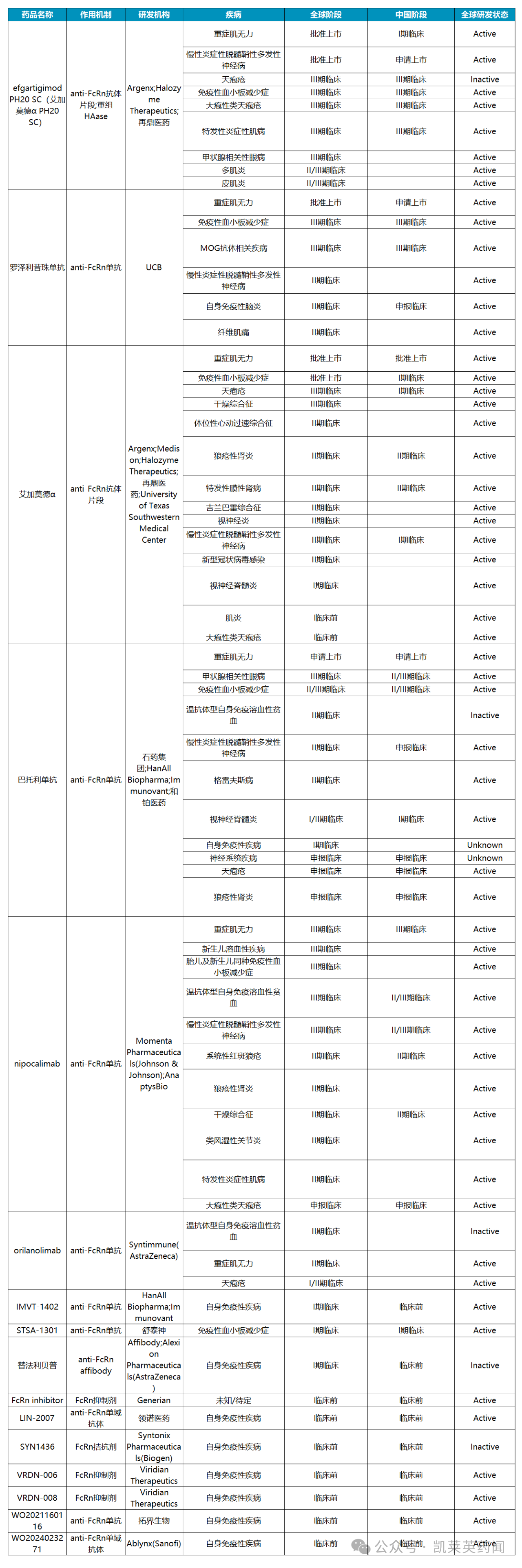
1、艾加莫德
艾加莫德(Efgartigimod)是一款针对抗体介导自身免疫疾病的、高度靶向IgG 的新型治疗药物,是全球首款FcRn 抑制剂。Efgartigimod 于2021 年12月获FDA批准上市,用于治疗乙酰胆碱受体(AChR)抗体阳性的成人全身型重症肌无力(gMG)。2024年6月,FDA批准了艾加莫德皮下注射(VYVGART Hytrulo)用于治疗慢性炎性脱髓鞘性多发性神经根神经病(CIDP)。
再鼎医药于2021年1月从Argenx 引进艾加莫德,拥有在大中华区(包括中国大陆、香港、澳门和台湾地区)的独家开发和商业化权利。2023年7月,NMPA批准了艾加莫德α注射液的生物制品上市许可申请,用于与常规治疗药物联合,治疗AChR抗体阳性的成人gMG患者;同月,该药物皮下注射剂型的生物制品上市许可申请(BLA)获NMPA受理,用于治疗成人gMG。2024年5月,CDE受理了艾加莫德皮下注射用于治疗慢性炎性脱髓鞘性多发性神经根神经病(CIDP)的补充生物制剂上市许可申请(sBLA),并于2024年5月11日纳入优先审评。
除此以外,日本厚生劳动省(MHLW)于2024年3月批准艾加莫德静脉输注剂型用于治疗原发免疫性血小板减少症(ITP)成人患者。同月,公司宣布,基于对2期临床研究RHO的数据分析,将计划继续推进艾加莫德在原发性干燥综合征(SjD)成人患者中的3期临床研究。
gMG:在关键性III 期ADAPT临床研究中,以1:1的比例随机分配接受efgartigimod或安慰剂。结果显示:研究达到主要研究终点:在乙酰胆碱受体抗体阳性(AChR Ab+)的gMG 患者中,根据重症肌无力日常生活活动(MG-ADL)评分,与安慰剂组相比,efgartigimod 治疗组有更高比例的患者为应答者(67.7%vs 29.7%;p<0.0001)。应答者被定义为在MG-ADL 评分上至少有2 分的改善,且连续4 周或更长时间。此外,efgartigimod 治疗组有40%的患者实现了微小状态表达(定义为MG-ADL 评分为0[无症状]或1),而安慰剂组实现这一目标的患者比例仅为11.1%。在AChR-Ab+应答者中,84.1%的患者在治疗的头2 周内MGADL评分有临床意义的改善。安全性方面,efgartigimod 治疗组与安慰剂相当(AEs:77% vs 84%),最常见的不良反应是头痛(29% vs 28%)、鼻咽炎(12% vs 18%)。此外,3期ADAPT-SC研究显示,在成年gMG患者中,与静脉输注相比,皮下注射剂型在第29天时总IgG的降低具有非劣效性。在第29天,与基线水平相比,艾加莫德α皮下注射剂型平均总IgG减少66.4%,而静脉输注剂型为62.2%。支持皮下注射剂的上市申请。
CIDP:ADHERE研究是迄今最大规模的治疗CIDP的临床研究;其中,69%(221/322)接受艾加莫德皮下注射治疗的患者,无论此前是否接受过治疗都确认出现临床改善,包括行动、功能和力量的改善。研究达到了主要研究终点(p<0.0001),研究证实,即与安慰剂相比,艾加莫德皮下注射可降低复发风险61%(HR:0.39 95% CI:0.25;0.61)。安全性与此前艾加莫德静脉输注临床研究和实际应用中的安全性特征基本一致。对中国患者的亚组分析显示,与安慰剂相比,艾加莫德皮下注射的复发率降低了69%。此外,在该研究的开放标签部分接受治疗的中国患者中,有78%表现出临床改善的证据(ECI)。
ITP:全球3期临床研究ADVANCE-IV结果已发表于2023年9月出版的《柳叶刀》,研究达到了主要终点,即与安慰剂相比,接受艾加莫德治疗的慢性ITP患者获得血小板计数持续应答的比例更高。研究显示艾加莫德治疗慢性ITP患者和持续性ITP患者起效快速,以及在国际工作组(IWG)评分中有51%缓解率(IWG评分是由ITP国际工作组制定的原发免疫性血小板减少症评估工具,与临床治疗高度相关)。在不同类型的患者中均观察到了主要终点应答者,无论患者年龄、疾病严重程度、确诊时间、既往ITP治疗或背景用药情况。在这项为期24周的研究中,艾加莫德耐受性良好,观察到的安全性和耐受性与此前的临床研究一致。
2、Rozanolixizumab
Rozanolixizumab是优时比(UCB)开发的一种皮下注射的人源化单克隆抗体,以高亲和力特异性结合FcRn;通过阻断FcRn 和免疫球蛋白 G (IgG) 的相互作用,加速抗体的分解代谢并降低致病性 IgG 自身抗体的浓度。2023年6月,FDA批准Rystiggo(rozanolixizumab)的上市申请,用于治疗gMG成人患者。
2023年5月,公司发布了一项随机、双盲、安慰剂平行对照、适应性两阶段设计的3期MycarinG试验数据,将300例患者随机接受rozanolixizumab治疗7 mg/kg或10 mg/kg或安慰剂,按每周一次皮下注射,治疗期为6周,随访观察期为8周。主要终点指标为MG-ADL,次要终点指标为MGC、QMG、患者自主报告的结局(PRO)及MG-ADL;安全性终点为导致治疗中断的不良事件(TEAEs)。结果显示:
(1)在治疗后的第43天,高、低剂量组均显现MG-ADL的大幅改善,相比基线变化值为–3.40与-3.37,安慰剂组为-0.78,且药物治疗组显著优于安慰剂组;(2)对MuSK抗体阳性gMG患者的亚组分析显示,高剂量组改善幅度为–4.16,低剂量组为-7.28,安慰剂组为2.28;(3)在治疗后的第43天,高、低剂量组在MGC、QMG分值及PRO的改善均显著优于安慰剂组;症状改善最早于治疗后的第8天显现,贯穿整个治疗期,直至第99天又恢复至基线水平。(4)MuSK抗体阳性gMG患者亚组显示,无论接受的是高剂量或低剂量药物,全部都获得MG-ADL明显改善(改善幅度≥2分),而安慰剂组仅14%(1/7)的患者达到这一改善幅度;以经治后达到最轻症状的患者比率看,高剂量组为28%,低剂量组为26%,安慰剂组为3%。(5)总IgG水平的大幅下降出现在治疗后的第8天,然后第99天恢复至基线水平。
在安全性上,任何TEAEs或药物相关TEAEs的发生率均很低,且与安慰剂组相近;高剂量组因TEAEs导致治疗中断的发生率略高,症状包括腹泻、上腹痛、呕吐、口腔疱疹、转移性鳞状细胞癌、瘙痒症和深静脉血栓形成。研究期间未出现死亡、严重超敏反应及自杀倾向的患者,患者对药物皮下注射的耐受性良好。
3、巴托利单抗
巴托利单抗(HBM9161)是一款抗FcRn单抗,可阻断FcRn-IgG相互结合,加速体内IgG(包括致病性IgG)的清除,有望为包括重症肌无力在内的致病性IgG介导的自身免疫性疾病带来新一代疗法。2022年10月,石药集团与和铂医药达成授权协议,取得巴托利单抗在大中华区的开发、生产和商业化权利。
2024年3月,公司公布了一项Ⅲ期临床研究结果,在这项随机、双盲、安慰剂对照平行研究中,共纳入132例全身型重症肌无力成人患者。这些患者随机分配至巴托利单抗治疗组及安慰剂组,进行以6周为一个周期的皮下注射治疗,以患者重症肌无力日常生活量表(MG-ADL)得分较基线的变化情况,评估巴托利单抗治疗对疾病症状的改善效果。数据显示,在治疗开始的第2周,巴托利单抗治疗组患者MG-ADL评分改善率曲线就较对照组产生了明显的分离,提示巴托利单抗治疗能够快速起效,改善症状;在第43天,结束了第一个治疗周期后,巴托利单抗治疗组的ADL评分持续改善率(ADL评分较基线改善3分且连续持续4周的比例)达58.2%(对照组为31.1%);在第一个治疗周期中,巴托利单抗治疗组患者达到最轻微症状表现(MSE,定义为ADL评分为0或1)的比例为25.4%,远高于对照组4.7%。除此以外,在MG定量评分、MG复合评分、15项重症肌无力生活质量评分分析中,巴托利单抗治疗组与对照组也呈现了相似的趋势;在安全性上,巴托利单抗治疗组与对照组治疗后出现的不良事件(TEAEs)发生率相近,总体耐受性及安全性数据良好。
4、nipocalimab
Nipocalimab(M281)可抑制FcRn介导的IgG循环,减少致病性IgG,同时保持正常IgG的产生。该药物获FDA和EMA授予胎儿和新生儿溶血性疾病(hddn)和温热性自身免疫性溶血性贫血(wAIHA)、gMG、胎儿新生儿同种免疫性血小板减少症(FNAIT)快速通道指定;获FDA和EMA授予wAIHA、hddn、慢性炎症性脱髓鞘多神经病变CIDP和和FNAIT孤儿药认定;获FDA授予hddn突破性疗法;获EMA授予hddn孤儿药认定。
在近期公布的这项双盲、安慰剂对照研究中,招募了广泛的抗AChR+、抗MuSK+和/或抗LRP4+患者,这些患者约占gMG患者群体的95%。与基线相较,在第22、23和24周,接受nipocalimab联合SOC治疗的患者在MG-ADL评分上平均改善了4.70分,显著高于安慰剂联合SOC治疗患者的3.25分(P=0.002)。除此以外,在关键的次要终点:(1)通过QMGd测量,在第22周和第24周,nipocalimab + SOC与安慰剂+ SOC相比,不同肌肉群的力量和功能的改善(P<0.001);(2)在第22、23和24周,与安慰剂加SOC相比,nipocalimab加SOC的MG-ADL反应(比基线改善≥2点)显著更高(P=0.021);(3)安全性和耐受性与其他研究一致。不良事件、严重不良事件和导致停药的不良事件的总发生率与安慰剂加当前SOC组相似。
5、Orilanolimab
Orilanolimab (SYNT001)是一种FcRn单抗,有望能改善多种由IgG介导的罕见病的治疗。该药物最初由Syntimmune公司开发,后由Alexion收购;2020年12月,阿斯利康拟斥资约390亿美元,收购Alexion公司;该药物正式纳入阿斯利康管线。目前,orilanolimab正在评估用于治疗温热自身免疫性溶血性贫血(WAIHA)患者和寻常型PV或PF患者。
参考资料:
1、各公司官网
2、中信建投、西南证券



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57