肿瘤血管生成是癌症的一个关键特征,它被诱导以帮助肿瘤获得维持生长所需的营养和氧气。血管生成可发生在肿瘤进展的任何阶段,并表现为从现有血管网络形成新的血管。与正常血管相比,肿瘤血管显示出通透性增加、形态不规则和组织不良。
内皮细胞(EC)和壁细胞(MC)是直接参与肿瘤血管生成的主要血管成分。内皮细胞亚群具有相当大的异质性,包含不同的血管类型和器官特异性特征。内皮细胞的可塑性使其成为抗血管生成疗法(AAT)的靶点,通过阻断血管生成信号来实现肿瘤血管正常化。在临床前研究中,将AAT与肿瘤免疫疗法相结合已显示出更强大的抗肿瘤效果。
2024年7月10日,重庆大学/重庆大学附属三峡医院印明柱教授团队在国际顶尖学术期刊 Nature 上发表了题为:Tumour vasculature at single-cell resolution 的研究论文。
该研究构建了迄今最大规模的泛癌种脉管系统全息细胞图谱,涵盖了来自372名捐赠者的约20万个细胞,代表了31种癌症类型。这项研究为充分理解肿瘤血管生成的复杂过程提供了全景视角,同时为临床提升抗血管生成疗效提供了科学方案。

肿瘤可通过血液供应获取其进展和转移所需的营养物质和氧气。诱导血管生成涉及已建立的血管床萌芽,并使其成熟为有组织的网络。
在这项最新研究中,研究团队生成了一个单细胞分辨率的肿瘤脉管系统全息细胞图谱,涵盖了来自372名捐赠者的约20万个细胞,代表了31种癌症类型。轨迹推断表明,肿瘤血管生成始于静脉内皮细胞,并向动脉内皮细胞延伸。随着新生血管的延长(通过血管生成阶段 SI、SII 和 SIII),SI 阶段的 APLN+尖端细胞(APLN+ TipSI)发展为具有增强的 Notch 信号的 TipSIII 细胞。同时,跟随尖端细胞(Tip cell)的柄细胞(Stalk cell)从高趋化因子表达转变为 TEK(也称为 Tie2)表达升高。此外,APLN+ TipSI 细胞不仅与疾病进展和不良预后相关,而且有望用于预测对 anti-VEGF 治疗的反应。
淋巴管内皮细胞表现出两种不同的分化谱系:一种负责淋巴管生成,另一种参与抗原呈递。在周细胞中,内质网应激与促血管生成的 BASP1+ 基质产生周细胞相关。此外,细胞间通讯分析表明,新生血管内皮细胞可以塑造有利于血管生成的免疫抑制微环境。
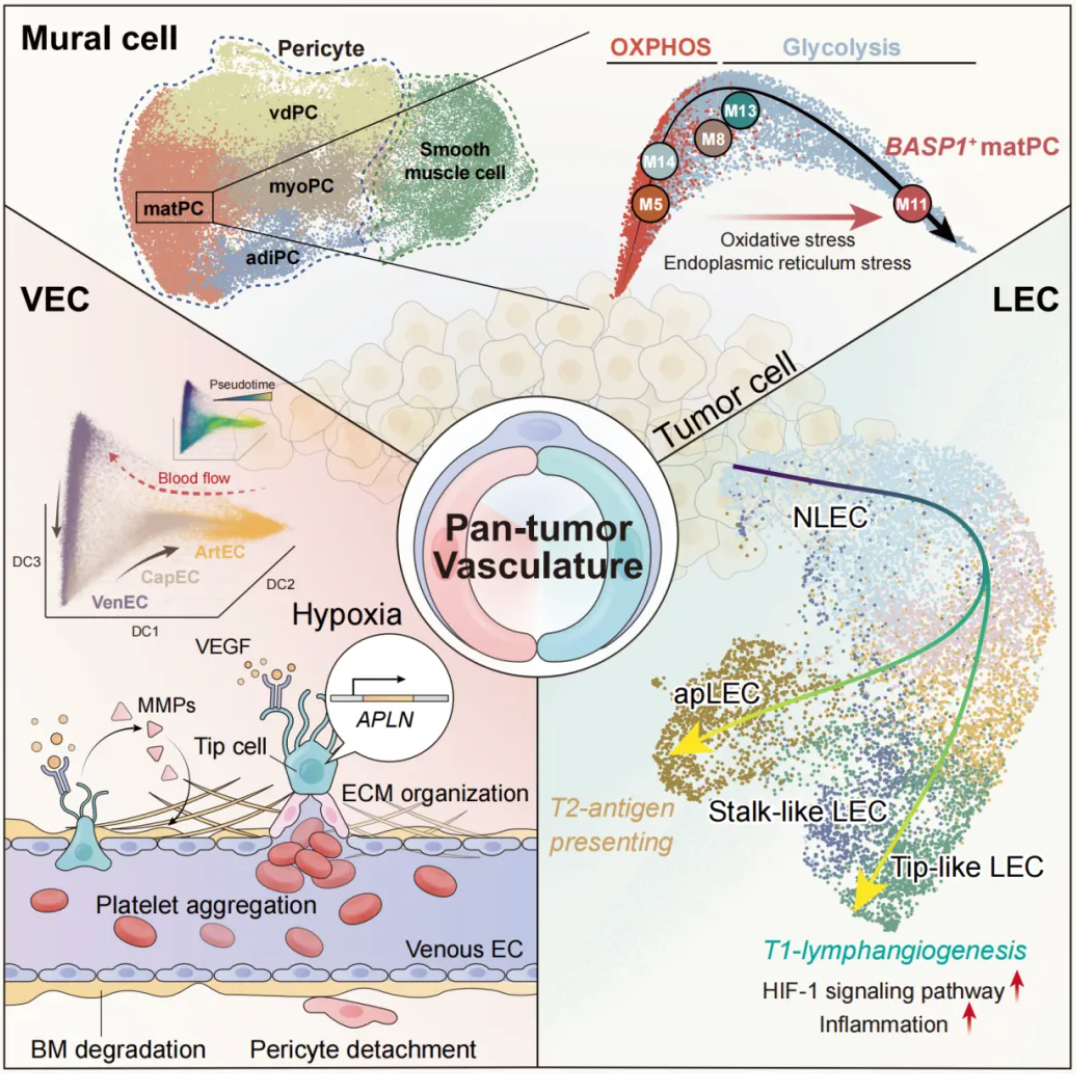
血管细胞、淋巴管细胞以及壁细胞的演进特征和关键调控机制
总的来说,这项研究描绘了肿瘤血管系统的复杂性,为充分理解肿瘤血管生成的复杂过程提供了全景视角,对抗血管生成治疗具有潜在临床意义。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57