医麦客新闻 eMedClub News
当地时间7月17日,Atara Biotherapeutics(以下简称“Atara”)宣布,其于5月向FDA提交的tabelecleucel(tab-cel)的生物制品许可申请(BLA)已被接受且获批优先审评资格,用于治疗爱泼斯坦-巴尔病毒(EBV)阳性的移植后淋巴增殖性疾病(PTLD)。
新闻稿指出,tab-cel作为单药疗法,用于至少接受过一次治疗的成人以及两岁以上的儿童患者。目前在这一治疗领域内尚无FDA批准的疗法,如果获批,tab-cel将成为FDA批准治疗EBV+ PTLD的首款疗法,也是首款同种异体T细胞免疫疗法。

EBV+ PTLD致病机制
EBV是最常见的人类病毒之一,是一种广泛传播的疱疹病毒,可引发多种严重疾病,包括传染性单核细胞增多症、鼻咽癌以及危及生命的PTLD等。研究表明,世界范围内95%以上的成人既往感染过此病毒。对患先天性免疫缺陷病的儿童来说,EB病毒感染可能成为致死性感染。其中EBV+ PTLD是一种可能致死的罕见血液癌症,可能在实体器官移植(SOT)或同种异体造血细胞移植(HCT)后发生。移植后的患者在常规应用免疫抑制剂来预防移植物抗宿主病(GVHD)后,人体的免疫功能减弱或发生缺陷,EBV特异性T淋巴细胞功能受损或缺失,导致EBV感染的B细胞可能不受控制地增殖,从而导致EBV+ PTLD。
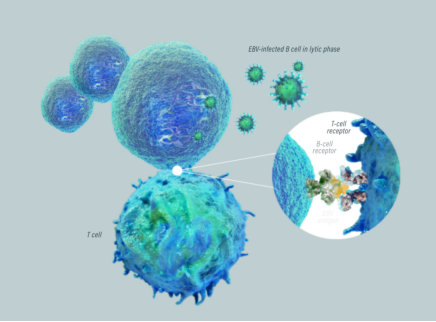
一线治疗失败的HCT后EBV+ PTLD患者的中位总生存期为16-56天,而SOT后高危EBV+ PTLD患者的1年和2年生存率分别为36%和0%。目前,这一适应症面临严重的未满足的医疗需求,传统治疗手段效果有限且预后不佳,一线治疗失败后的生存率极低。
同种异体T细胞免疫疗法
同种异体T细胞免疫疗法是指从健康者体内获取免疫细胞,经过工程改造和扩增最后输入患者体内的疗法,也被称为通用型或者现货型免疫细胞疗法。同种异体T细胞免疫疗法有两大障碍:异体细胞对受体或宿主的攻击(GVHD)以及受体或宿主对异体细胞的免疫排斥(HvGR)。要解决上述两大问题,需要通过基因编辑或非基因编辑手段进一步改造,比如敲除或破坏T细胞受体的表达避免GVHD发生以及其他靶点改造避免HvGR,使其能在患者体内存活并有效识别和杀伤肿瘤细胞。
Tab-cel
Tab-cel是一种同种异体、“现货型” EBV特异性T细胞免疫疗法,旨在以人类白细胞抗原(HLA)限定的方式靶向受EVB感染的细胞。该疗法基于Atara的EBV T细胞平台研发。Atara开发的同种异体EBV T细胞免疫疗法平台可以提前制备相应的T细胞并进行储存。该疗法除了针对利妥昔单抗治疗失败的移植后EBV+ PTLD患者,还计划用于治疗包括鼻咽癌在内的其他EBV相关血液癌症和实体瘤。
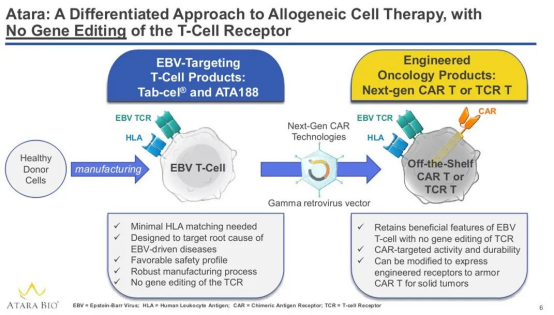
▲ 靶向EBV现货型T细胞疗法原理
相关资料显示,美国FDA已授予了tab-cel 用于治疗HCT后产生EBV+ PTLD的突破性疗法认定(BTD)。此疗法亦获得欧盟孤儿药资格与优先药物资格(PRIME)。此前,欧盟委员会、英国和瑞士的监管机构也分别批准了tab-cel上市,商品名为Ebvallo。
本次BLA的提交是基于超过430名患者的数据的支持。其中,关键性临床试验ALLELE的数据显示,tab-cel达到48.8%的客观缓解率(p<0.0001)。
Atara总裁兼首席执行官Pascal Touchon表示:“FDA接受了我们提交的BLA意味着一次重要的里程碑,同时tab-cel能获得FDA的优先审查也说明EBV+ PTLD还存在着极大的未满足的需求。这是一种毁灭性的疾病,治疗选择有限,总体生存率低。我们将继续与Pierre Fabre实验室密切合作,为2025年初在美国可能的上市做准备。”
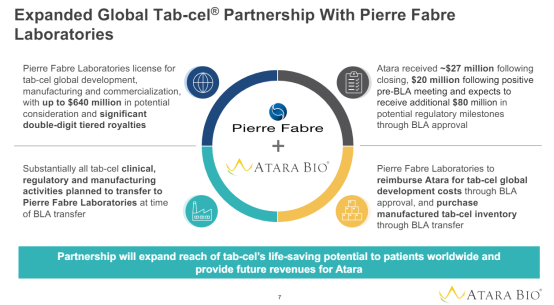
据悉,2023年11月,Atara与Pierre Fabre达成了相关合作协议,Pierre Fabre囊获了tab-cel的全球开发和商业化权益。根据协议条款,Atara有望获得多项里程碑付款。本次tab-cel的BLA被FDA接受意味着Atara将从Pierre Fabre获得2000万美元的里程碑付款,而在BLA获FDA批准后,Atara还可以额外再获得6000万美元的里程碑付款。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57