去甲肾上腺素(NE)、多巴胺(DA)和血清素(5-HT)是重要的单胺类神经递质,影响着包括运动、激素分泌、奖惩和情绪相关的复杂行为和生理过程。这些神经递质在突触前膜去极化后释放到突触间隙,随后激活突触后膜上的受体并触发影响神经元兴奋性、突触可塑性和各种生理过程的细胞内信号级联。
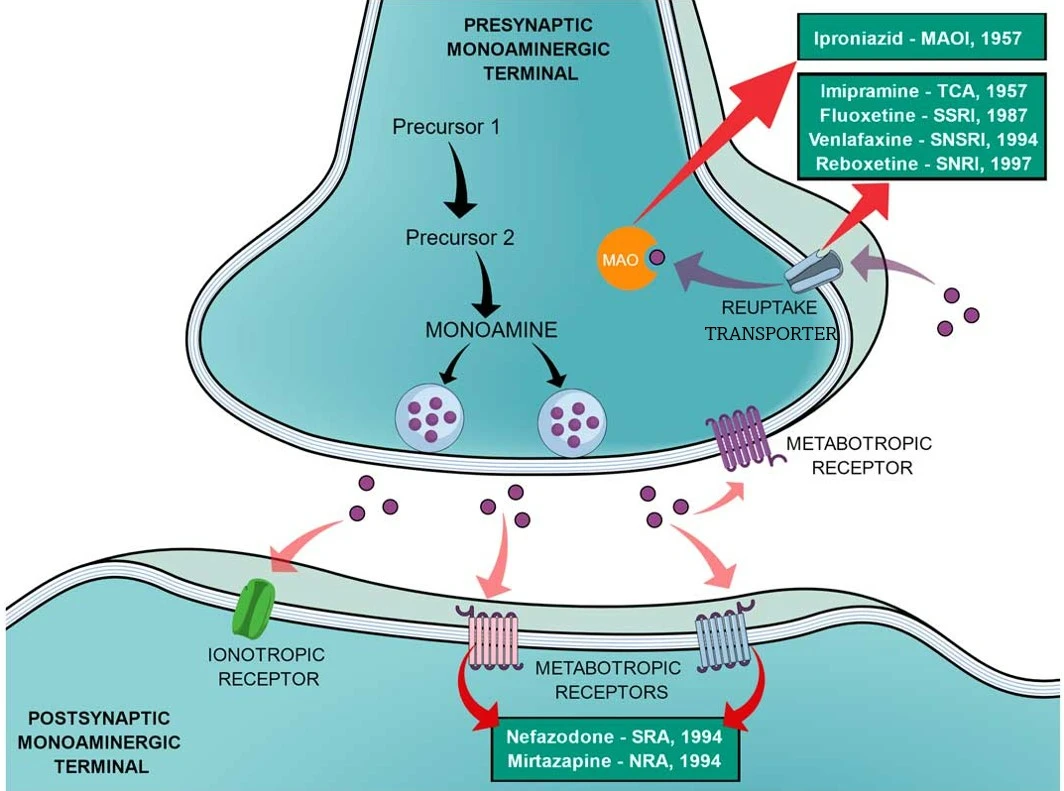
去甲肾上腺素(NE)、多巴胺(DA)和血清素(5-HT)是重要的单胺类神经递质,影响着包括运动、激素分泌、奖惩和情绪相关的复杂行为和生理过程。这些神经递质在突触前膜去极化后释放到突触间隙,随后激活突触后膜上的受体并触发影响神经元兴奋性、突触可塑性和各种生理过程的细胞内信号级联。正常生理情况下,从突触前神经元释放的神经递质,在完成信号传导后必须及时高效地从突触间隙被清除,从而实现信号终止。通过突触前神经元或者神经胶质细胞质膜上的单胺类神经递质转运蛋白(MAT),可以将单胺类神经递质再摄取回突触前膜从而终止其对下游受体的激活状态。目前,MAT家族抑制剂主要在医药市场上用作抗抑郁药,可根据其化学结构和作用方式分为不同的类别(图1)。
图1:单胺能神经元中神经递质的传递过程及不同抗抑郁药物的作用方式
MAT属于神经递质钠同向转运蛋白(NSS)家族成员,其利用膜外/内钠离子Na+的浓度梯度来完成对神经递质的同向跨膜运输,这一过程可能依赖于氯离子Cl-同向转运以及钾离子K+的反向转运。近年来对MAT中底物转运及抗抑郁药物调节机制的研究进展迅速,其中果蝇多巴胺转运蛋白dDAT和人源血清素转运蛋白SERT的不同构象以及与多种抗抑郁药物分子结合的结构已经得到解析。但关于人源去甲肾上腺素转运蛋白NET的结构研究相对进展缓慢,这大大阻碍了抗抑郁药物的进一步优化和开发。
2024年7月24日,清华大学生命科学学院/北京生物结构前沿研究中心闫创业/袁亚飞团队在 Nature期刊发表了题为:Molecular basis of human noradrenaline transporter reuptake and inhibition(人类去甲肾上腺素转运蛋白再摄取与抑制分子基础)的研究论文。
该研究通过结构生物学和生物化学方法阐明了去甲肾上腺素转运体(NET)转运底物去甲肾上腺素(NE)和多巴胺(DA)的机制,首次报道了NET中的第二个底物结合位点和NSS家族的钾离子结合位点,揭示了四种不同类别的常用上市抗抑郁药物的选择性抑制机制,为进一步开发靶向单胺类神经递质转运蛋白(MAT)的药物奠定了基础。
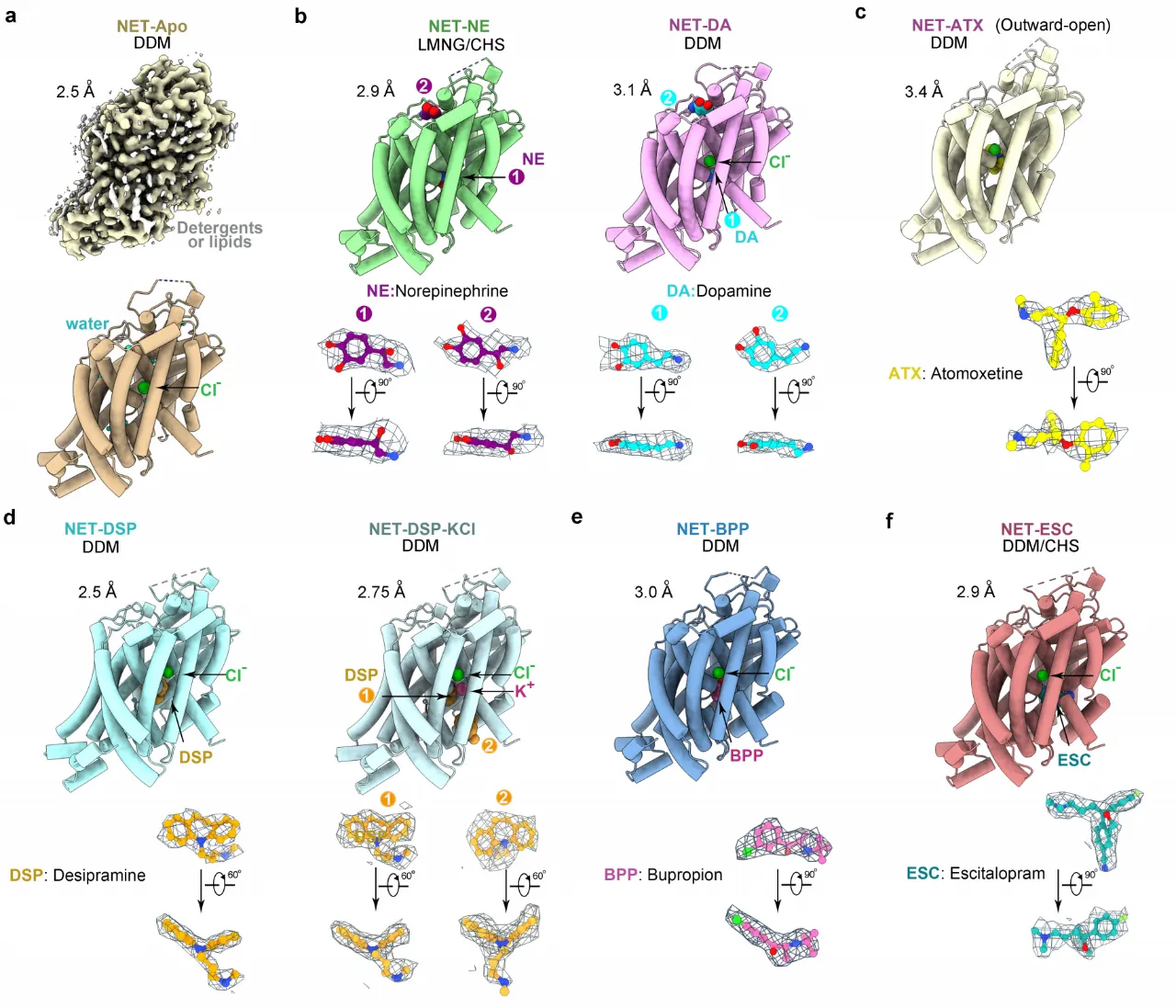
研究团队利用冷冻电镜技术成功解析了人源NET蛋白的八个高分辨率结构,包括天然状态、结合底物(NE、DA)和四种常用上市抗抑郁药物(托莫西汀:Atomoxetine,ATX;地昔帕明 :Desipramine,DSP;艾司西酞普兰:Escitalopram,ESC;安非他酮:Bupropion,BPP)的结合状态。这些结构是天然蛋白在未使用任何基准标记或突变的情况下获得,分辨率在2.5到3.5埃之间(图2)。
图2:人源NET天然状态、结合两种底物和四种抗抑郁药物复合物的冷冻电镜结构
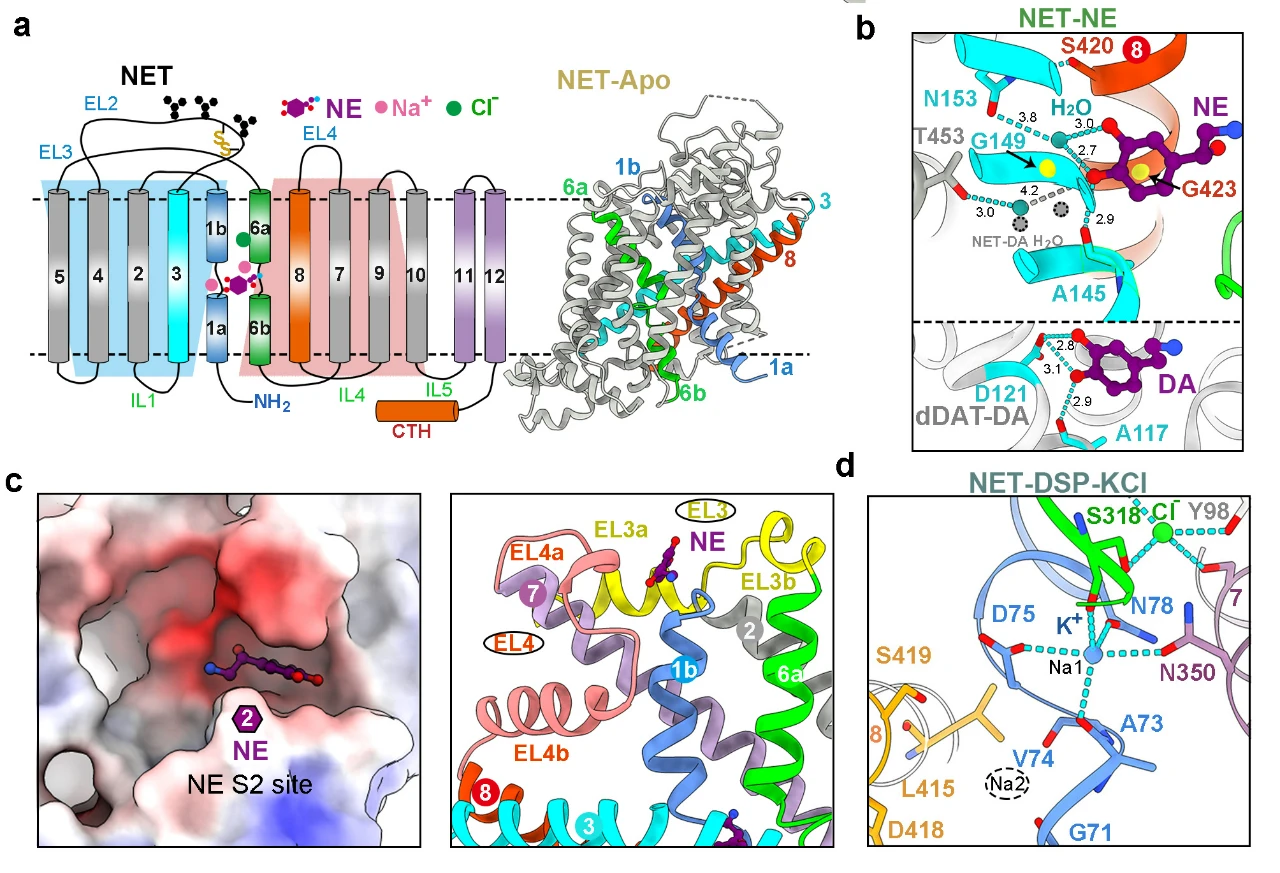
研究发现,NET中央口袋S1处识别NE或DA的方式与报道的果蝇dDAT不同,其儿茶酚环上的两个羟基主要通过水介导的氢键识别 (图3a,b)。此外,研究在NET与两种底物结合的结构中都观测到了第二个底物的密度(S2位点)。值得注意的是,与已报道的SERT中的S2位点显著不同,NET中的S2位点位于TM1b C末端,且仅存在于向内闭合或开放的构象中,向外开放构象转变会导致S2位点被破坏(图3c)。通过生化实验发现,S2位点内的某些突变显著影响转运蛋白的转运速度。推测NET中S2位点的功能可能是提前加载底物,从而加快底物转运效率。
图3:NET中心口袋S1的底物结合方式(a-b)、S2位点(c)及K+离子结合位点(d)
MAT成员是离子耦合的膜蛋白,作为次级主动转运蛋白,它们共享两个保守的Na+结合位点(Na1和Na2)和一个保守的Cl-结合位点,利用跨膜离子梯度的能量来催动神经递质的运输(图3a)。早在1979年时K+离子就被提出参与MAT的转运循环,但直到现在实验结构仍未确定特定的K+结合位点。研究团队在向内开口的NET-DSP-KCl结构的Na1位点处发现了K+的额外密度,而该密度在NaCl条件下的NET内向开口构象中并不存在 。据此,该研究首次通过结构验证了NSS家族中K+离子的结合位点。这一K+离子位点恰好是Na1位点,该位点在向内开口释放Na+离子之后,局部残基构象发生改变,使得该位点更偏好螯合K+离子(图3d)。尽管确认了Na1处K+的存在及其在运输中的作用,但其触发构象转变的确切机制仍需要进一步研究。
深入了解不同抗抑郁药物对MAT的选择性抑制的分子基础对于抗抑郁药物的开发和应用具有重要意义。托莫西汀是一种NE再摄取抑制剂(NRI),其对NET的选择性比SERT和DAT高约30倍和130倍;地昔帕明是三环类抗抑郁药(TCA),其对NET的选择性比SERT高约20倍;安非他酮是典型的NE和DA再摄取抑制剂(NDRI);而艾司西酞普兰是一种典型的选择性血清素再摄取抑制剂(SSRI),其对SERT的选择性比NET高约2600倍。
该研究通过解析四种不同类型的抗抑郁药物的高分辨率结构,为理解其对NET、DAT和SERT选择性提供了分子基础。通过不同抑制剂浓度的[3H]-NE摄取测定,该研究进一步揭示了托莫西汀的竞争性抑制及其它三种抑制剂的混合型抑制机制与结合不同构象相关。这些研究为理解靶向MAT的抗抑郁药物选择性提供了重要见解,MAT抗抑郁药独特的结合模式和多靶点特性值得制药行业特别关注。
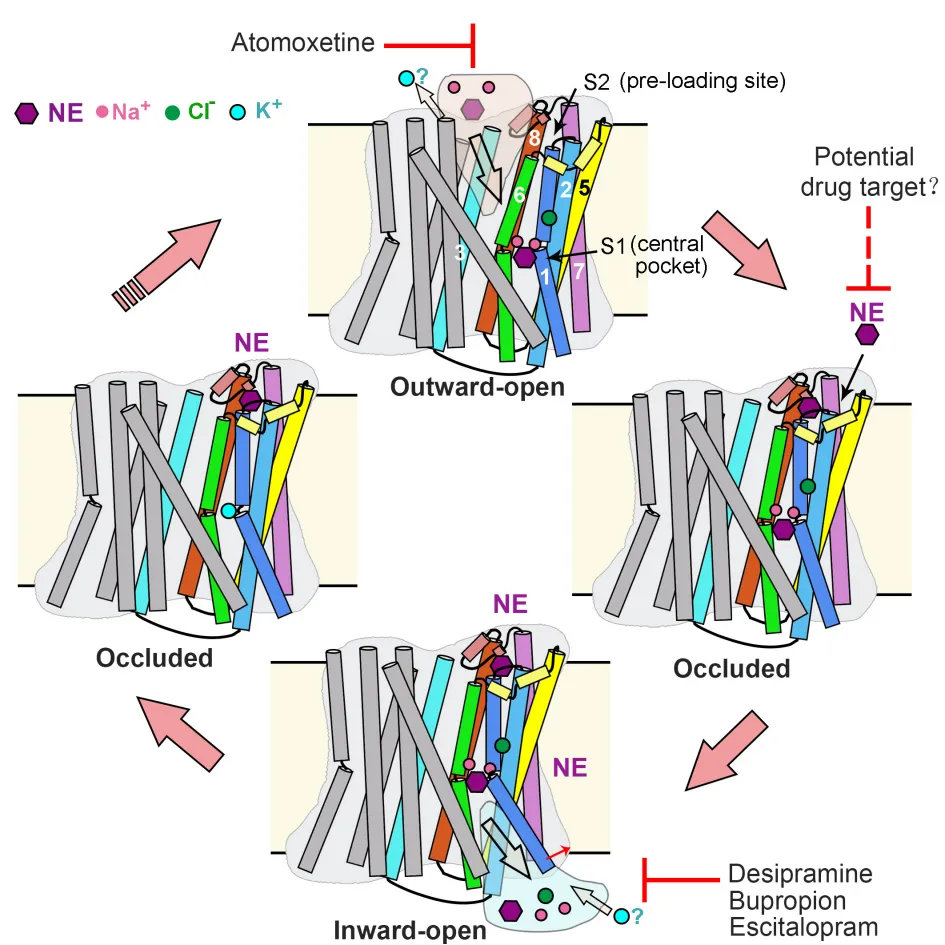
综上,研究团队提出了NET的转运过程模型(图4)。在向外开放的构象中,Na+、Cl-和底物NE与中央口袋结合,启动NET的闭合,进入闭合状态。在这个转变过程中,第二个底物可以提前结合到新形成的膜外S2位点中。随后,TM1a的打开(向内开放构象的标志特征)促进底物与两个Na+一起从中央口袋释放。在转变回向外开放构象的过程中,S2位点的局部结构将受到破坏,导致S2位点处底物的释放。释放的底物可能直接进入到中央口袋,开始下一个转运循环。这一过程与两个Na+离子和一个Cl-离子进入细胞质以及可能一个K+离子进入细胞外基质的转运耦合。而不同类别的抗抑郁药物占据S1位点阻碍底物转运。
图4:NET的交替开放转运模型和抑制机制
该研究亮点:首次发现了NET的第二个底物结合位点以及NSS家族的K+结合位点,揭示了NET底物识别机制、交替开放转运模型、以及不同类别抗抑郁药物选择性抑制的分子机制,为抗抑郁药物的进一步研发提供了基础。




![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57