7月29日,根据CDE官网公示,GSK的多塔利单抗(Dostarlimab,商品名Jemperli)获临床试验默示许可,拟用于治疗局部晚期、初治错配修复缺陷型(dMMR)/高微卫星不稳定性(MSI-H)直肠癌成人患者。

Dostarlimab在2021年4月获美国FDA批准,作为在先前接受过含铂疗法后的dMMR晚期或复发性子宫内膜癌的单药治疗。而后在2023年7月获批与卡铂和紫杉醇联合用药,并接续Dostarlimab作为单药以治疗由美国FDA批准的检测方法确定为dMMR或MSI-H的原发性晚期或复发性子宫内膜癌成人患者。
Dostarlimab在2021年8月获FDA加速批准用于治疗携带dMMR的复发或晚期实体瘤患者,这些患者的dMMR特征由FDA批准的检测确认,在接受前期治疗后疾病继续进展,并且没有其它满意的替代治疗选择。
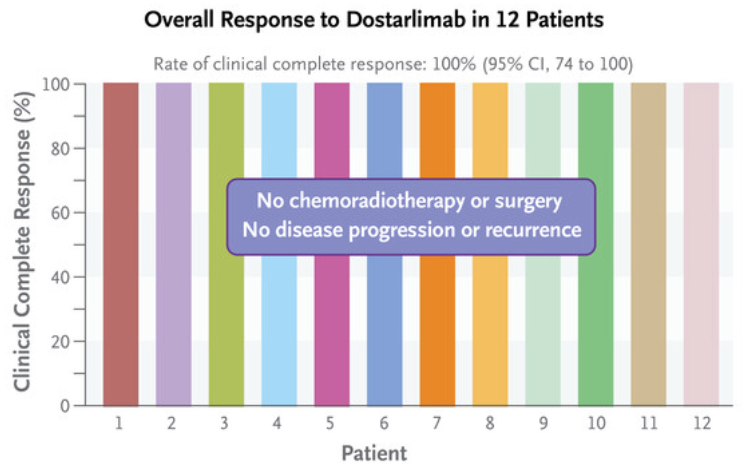
发表在《新英格兰医学杂志》上的Dostarlimab的结果

NCCN指南推荐多斯塔利单抗用于dMMR/MSI-H直肠癌新辅助/针对性免疫治疗

Dostarlimab单药治疗的2期研究(NCT05723562)

Dostarlimab单药治疗的3期研究(NCT05855200)
参考资料:



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57