7月30日,根据CDE官网公示,普米斯生物的靶向CLDN18.2/4-1BB双抗PM1032注射液获临床试验默示许可,拟用于联合化疗治疗局部晚期/转移性胰腺癌。
PM1032是一种条件激活型4-1BB激动剂,能够在高表达CLDN18.2的肿瘤局部诱导CLDN18.2依赖的特异性4-1BB信号通路的激活,增强肿瘤微环境中的T细胞活性并诱导肿瘤抗原特异性的记忆T细胞的生成。同时,独特的4-1BB结合位点以及对Fc的改造最大限度地降低了PM1032在CLDN18.2阴性环境中对T细胞的激活,大大降低了系统性毒性。
目前PM1032正在国内开展I/ IIa期临床试验,评价PM1032注射液在晚期实体肿瘤受试者中的耐受性、安全性、药代动力学特征和初步疗效的I/ IIa期临床研究
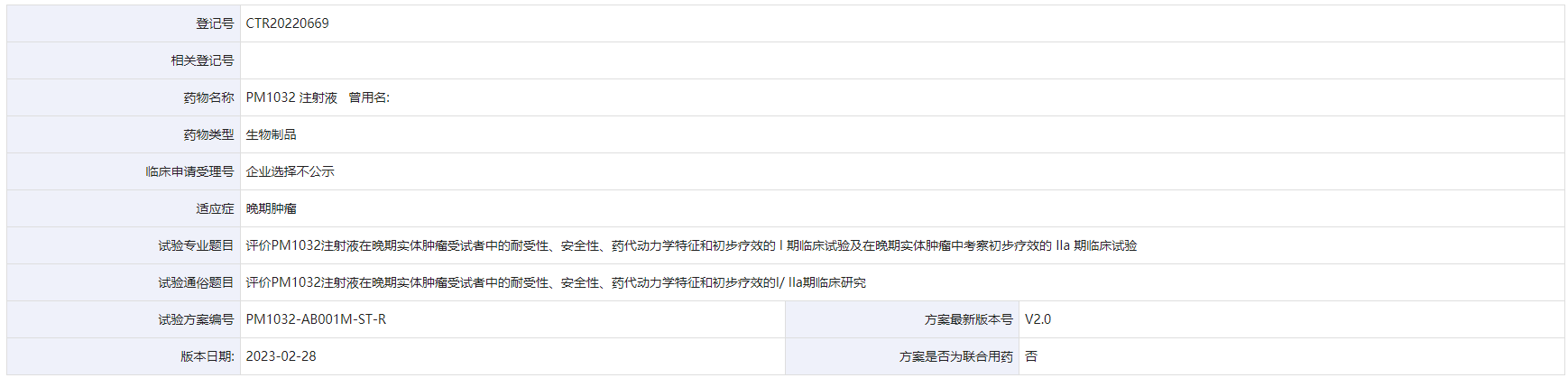
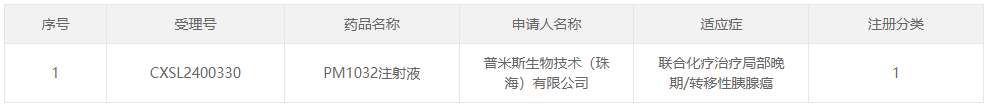
药物临床试验登记与信息公示平台上PM1032的临床试验
在2022年AACR会议报道上报道了PM1032的体内药效研究,PM1032可使多种肿瘤移植瘤消退,并且伴随着免疫记忆的产生,治愈后的小鼠再次接种同种肿瘤细胞后不能成瘤。
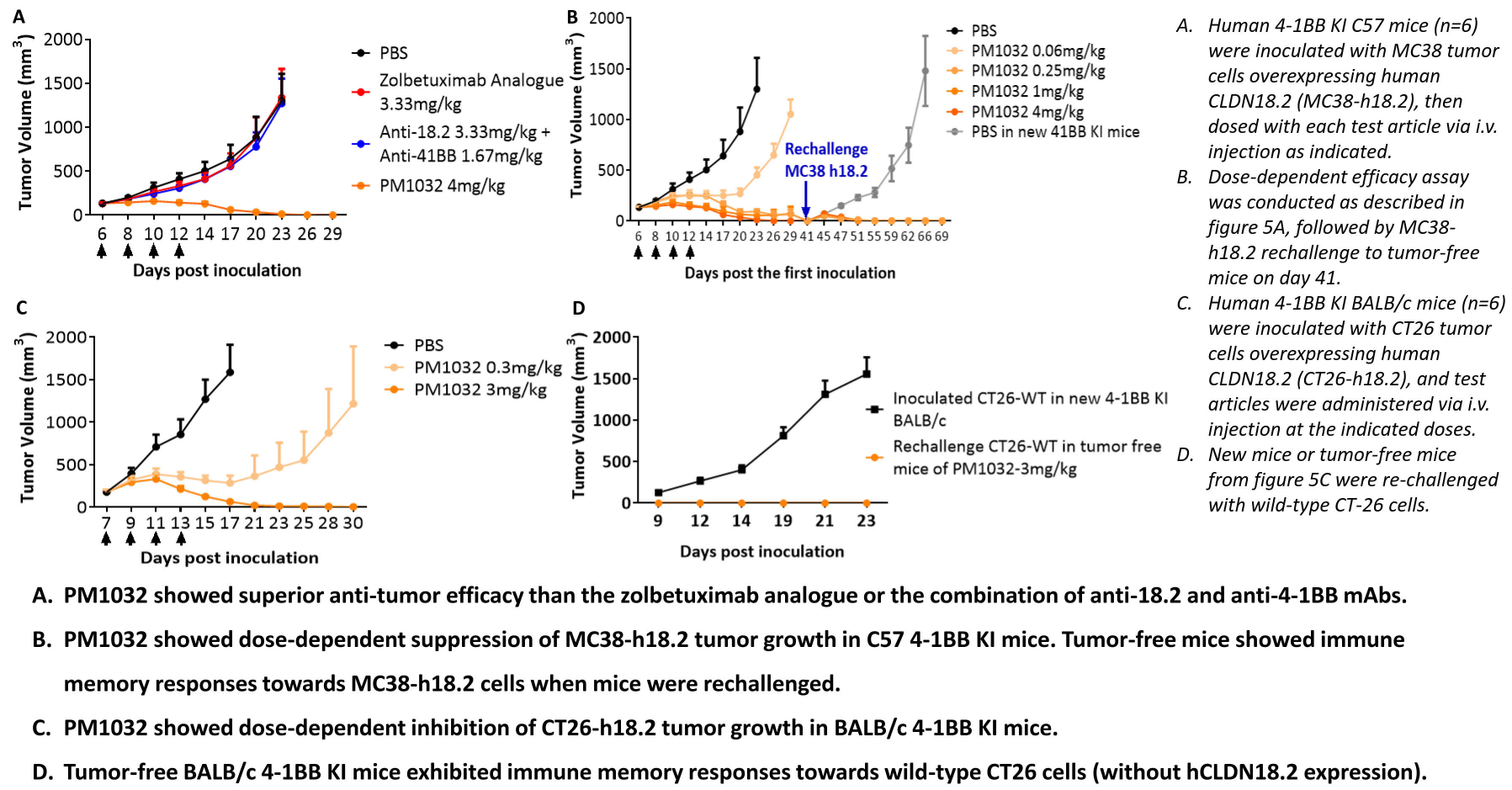
PM1032在体内可抑制肿瘤生长并诱导免疫记忆
在恒河猴重复给药毒性试验中,以最高给药剂量150 mg/kg给药的安全性和耐受性良好。
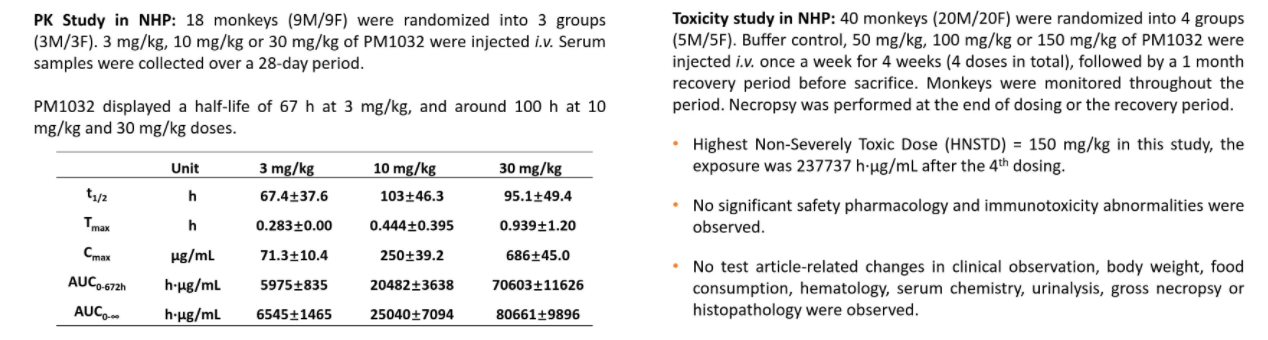
PM1032表现出典型的抗体样PK且在恒河猴中耐受性良好
在2024年ASCO年会上,披露了PM1032在晚期实体瘤患者中的首次人体I/II期安全性和初步疗效最新研究数据。

2024年ASCO上PM1032的poster(来源于网络)
在这项I/II期试验中的剂量递增阶段,PM1032的给药剂量分别为0.3、1、3、5、8 和12mg/kg,3 周后评估药物限制性毒性 (DLT),然后每2周给药一次,直至疾病进展 (PD) 或观察到无法耐受的毒性。结果显示:
在5、8和12mg/kg 剂量水平下入组并完成至少一次肿瘤评估的16名 CLDN18.2阳性患者中,2名患者获得PR,7名患者获得SD,3名患者为非CR/非PD。此外,在10名可测量和可评估的 CLDN18.2阳性GC/GEJ 患者中,ORR为20%。最长治疗时间为18个月,5名患者的治疗时间≥6个月。
作为相同靶点的天境生物TJ-CD4B目前也正在进行临床1期。 2022年3月,TJ-CD4B获得美国FDA授予针对治疗胃癌(包括胃食管交界处癌)的孤儿药资格认定。
附录:CLDN18.2靶点双抗汇总
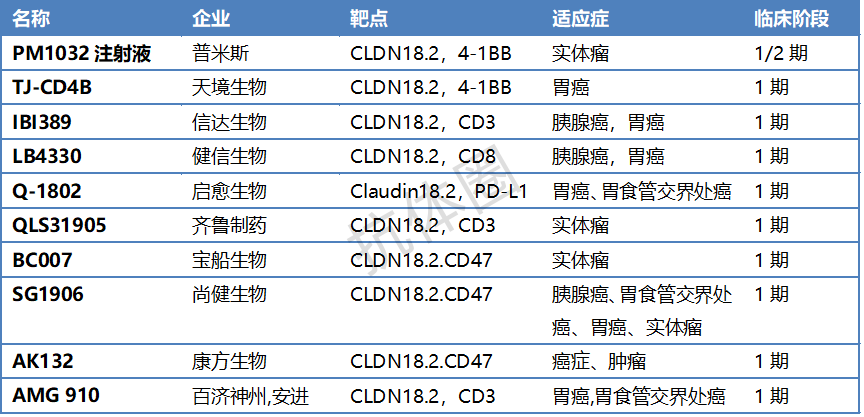
资料来源:
1.普米斯生物官网
2.CDE官网



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57