背景:在哺乳动物细胞中短暂表达蛋白是许多有关人类和高等真核基因功能和结构研究的关键技术,同时也用于生产重组蛋白治疗剂。最大化表达效率以获得更高的表达产量是可取的,甚至在某些情况下可能至关重要,例如,当需要在单细胞水平上对表达的蛋白进行表征时。
新方法:我们的目标是开发一种简单的方法,通过短暂处理二甲基亚砜(DMSO)溶液来提高人类胚胎肾(HEK)-293细胞中的蛋白表达产量。
结果:通过使用钙磷酸盐转染方法表达绿色荧光蛋白(GFP)作为报告蛋白,并成像大量细胞群体,我们发现在转染感兴趣蛋白后4小时,对HEK-293细胞进行5分钟10% DMSO的处理,可以在不引起任何显著细胞毒性的情况下,使表达产量增加约1.6倍。通过在HEK-293细胞中分别表达α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)和一种兴奋性氨基酸受体,并测量谷氨酸诱导的全细胞电流反应,我们还发现这种短暂的DMSO处理不影响通道活性。
结论:这种方法简单、高效且成本低廉,可用于提高HEK-293细胞中短暂转染的产量。

二甲基亚砜(DMSO)作为一种关键的极性非质子溶剂,在室温条件下呈透明无色液态。它不仅在化学反应中扮演重要角色,也常作为溶剂使用。DMSO的两亲性质使其能有效溶解多种小分子疏水性药物。此外,DMSO还因其卓越的膜渗透性而广泛应用于细胞和组织的冷冻保护。DMSO能够改变细胞膜的通透性,促进DNA质粒的细胞内摄取,从而可能提升蛋白表达水平。
本研究旨在探索DMSO对HEK-293细胞转染效率的潜在提升作用。研究将确定DMSO的最佳作用浓度和时间,以期在不引起细胞毒性的前提下最大化转染效率。需要注意的是,DMSO在活细胞中的浓度越高或作用时间越长,其细胞毒性可能越大,因为DMSO可能降低细胞膜的刚性,高浓度下甚至可能诱导膜孔的形成。HEK-293细胞系是一种广泛应用于重组蛋白表达的细胞系,其转染效率高,翻译后修饰正确,且蛋白表达速度快,通常在48小时内达到高峰。对于需要在单细胞水平研究膜蛋白的科研人员来说,提高HEK-293细胞中重组蛋白的表达效率尤为关键。
本实验进一步研究了DMSO处理对HEK-293细胞转染效率和表达量的影响。研究团队采用GFP作为报告蛋白,通过测定表达GFP的细胞百分比来评估转染效率,并监测DMSO对细胞可能造成的潜在损害。最终,研究选用了磷酸钙法进行HEK-293细胞的瞬时转染。尽管市场上有许多基于脂质体的转染试剂,磷酸钙法依然是一种简便、高效且成本低廉的转染手段,适用于多种贴壁和悬浮细胞的转染工作。
结果
DMSO的作用
为了探究DMSO对HEK-293细胞中重组蛋白短暂表达的影响,研究团队首先进行了GFP的转染实验。与未处理的对照组相比(见图1A右侧),在细胞转染后4小时加入DMSO至培养基中,似乎能够提升GFP阳性细胞的数量(见图1B右侧)。实验图像显示,与未经DMSO处理的培养皿相比,经过DMSO处理的培养皿中观察到更多或更亮的GFP阳性细胞(见图1C及其说明)。
在转染GFP质粒后的4小时内,研究者将DMSO加入到细胞培养中。常规操作中,转染液被添加到细胞上,随后培养皿被放回37℃的培养箱中。4小时后,转染液被常规生长培养基替换。研究者尝试将DMSO与转染液预先混合后加入细胞,但发现这样做会导致活细胞数量显著减少,这可能是由于DMSO与细胞共孵育4小时对细胞产生了毒性。此外,研究者还发现,将DMSO与转染液混合会在混合物中形成沉淀。
因此,研究者决定在细胞转染后等待4小时再进行DMSO处理。也就是说,在转染4小时后,研究者取出转染的培养皿,首先用PBS进行洗涤,然后进行DMSO处理。DMSO处理结束后,再次用PBS洗涤培养皿,并在放回培养箱前补充完全生长培养基。这一调整后的步骤有助于避免DMSO可能引起的细胞毒性,同时保持了转染效率。
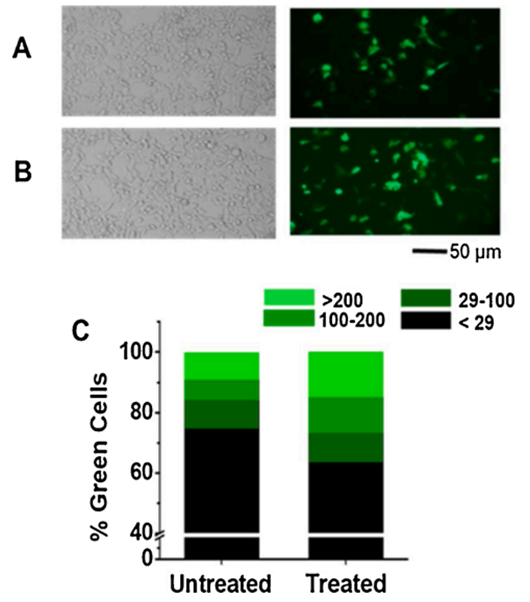
图1:DMSO对HEK-293T细胞中GFP瞬转表达的影响
最佳DMSO浓度和赋予时间的研究
随后,研究者着手探究用于转染HEK-293细胞的DMSO处理的最佳浓度和时间。这一点至关重要,因为DMSO在较高浓度或长时间作用下可能会对细胞造成伤害。众所周知,DMSO即使在较低浓度下,长时间接触也可能带来细胞毒性。为了找到最合适的DMSO浓度,研究者在PBS中对4种不同浓度的DMSO进行了测试,这些浓度分别是5%、10%、15%和20%(体积比%;见图2),处理时间为5分钟,同时设有对照组,即未经DMSO处理,仅用PBS缓冲液处理的培养皿。根据图2A的结果,10%的DMSO处理能够带来更高比例的GFP阳性细胞。与此相对,5% DMSO并未相较于对照组显著增加GFP阳性细胞的数量。而更高浓度的DMSO处理则导致GFP阳性细胞数量显著下降。在10% DMSO浓度下,研究者还观察到亮度最高的GFP阳性细胞百分比最高。
在确定了10%为最佳DMSO浓度后,研究者接着测试了不同的处理时间,从2分钟到15分钟不等,以10% DMSO溶液在室温下孵育细胞。结果显示,大约5分钟的孵育时间最为理想(见图2B)。与对照组相比,较短的孵育时间(如2分钟)对GFP阳性细胞数量的影响不大。而当DMSO孵育时间超过5分钟后,GFP阳性细胞数量有所下降。综合图1和图2的实验结果,研究者得出结论,10% DMSO溶液对转染细胞进行5分钟的孵育是最佳方案。
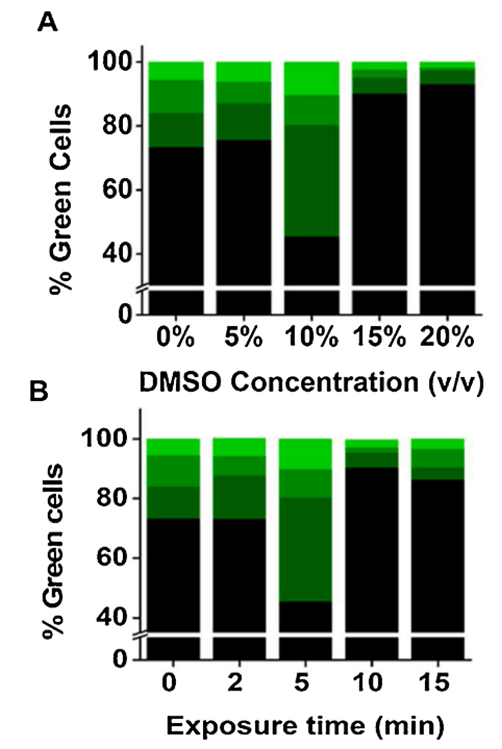
图2:确定DMSO的最佳浓度和孵育时间
DMSO孵育后GFP表达随时间的变化
接着,研究者对经DMSO处理的培养皿中GFP表达水平随时间的变化进行了追踪观察。具体而言,他们对DMSO处理组和对照组(未处理)培养皿中6天内表达GFP的细胞百分比进行了测定。研究结果显示,在观察期间,DMSO处理组的GFP表达始终高于未处理组(对照组见图3B,处理组见图3A)。此外,两组细胞在培养第2天均达到GFP表达的峰值(见图3C)。通过分析第2天的数据,研究者发现,在转染后4小时采用5% DMSO进行5分钟处理的培养皿中,表达GFP的细胞平均增加了约1.6倍。
从第3天起,两组细胞培养液的总体荧光强度开始逐步下降(见图3C)。研究者还发现,在33℃的较低温度下培养细胞,与37℃标准培养温度相比,低温环境有助于保持更多的细胞存活。实际上,未处理的细胞在第2天后也表现出类似的下降趋势(见图3C),这与研究者之前对常规HEK-293细胞培养条件(无DMSO处理)的观察相符,进一步证实了短时间DMSO孵育(5分钟)对转染后的HEK-293细胞状态的影响微乎其微。
综合分析,从第2天起绿色细胞百分比的下降可能主要是由于蛋白质的内在降解和/或细胞的裂解。有研究指出,GFP在哺乳动物细胞中的半衰期大约为26小时。在哺乳动物细胞(如HEK-293细胞)中进行重组蛋白的瞬时转染时,通常选择在转染后24至72小时内收集细胞,因为这个时间段内蛋白质的表达量最高。研究者所观察到的现象(见图3)正符合这一时间窗口。
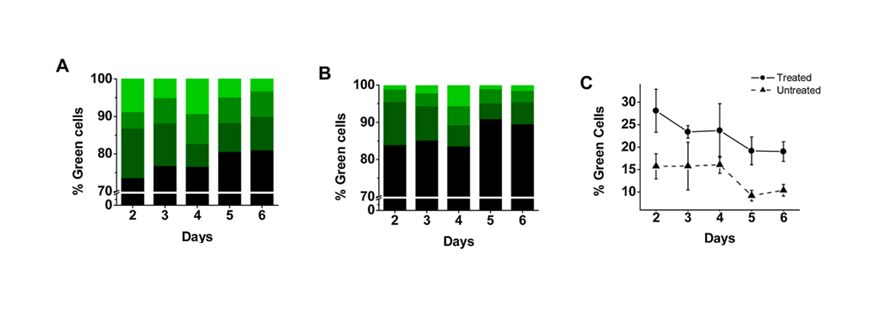
图3:DMSO孵育后GFP表达的时间过程
结论
短暂转染的哺乳动物细胞培养物表达重组蛋白的生产力取决于多种因素。这些因素包括宿主细胞类型、基因转录和翻译速率、基因表达的稳定性、细胞中的翻译后修饰以及转染效率。一旦选择了细胞来源或细胞系,操纵转染效率可能是提高基因产物产量最有效的方法之一。使HEK-293细胞成为短暂基因表达系统的一个吸引人的选择的各种属性之一是这些细胞可以很容易地被操纵。基于这一理念,我们研究了,并在这里报告,短暂暴露DMSO对转染细胞的生产力对短暂表达产量的影响。正如我们在这项研究中所展示的,将10% DMSO暴露于4小时后转染感兴趣重组蛋白的HEK-293细胞,可以提高表达产量约1.6倍,而对细胞的活性或生长没有任何负面影响。
我们研究中的一个重要发现是,DMSO对细胞的暴露应该在细胞已经暴露于转染试剂后4小时发生;在我们的例子中,我们使用了钙磷酸盐DNA共沉淀。在这种情况下,认为与细胞的转染混合物4小时孵化足以允许吸收细胞表面的外来DNA。这是我们通常会用完整培养基替换转染溶液,然后将转染培养物放回孵化器的时间。因此,用DMSO处理培养物5分钟只是完整培养基交换之前的一个额外步骤。然而,应注意,在DMSO处理后进行培养基替换期间,因为经过DMSO处理的细胞容易在培养基交换时被冲走。如果一个人希望收获整个培养物而不仅仅是使用一小部分细胞进行电生理学研究,这一点将特别重要。关于这一点,我们还最初尝试使用相同的协议,即5分钟10% DMSO处理,使用悬浮适应的HEK-293S细胞。我们发现在HEK-293S细胞中也有类似的增强,但是培养皿必须首先涂覆胶原蛋白;否则在去除DMSO溶液并清洗培养皿之前,会有大量的细胞丢失。显然,通过移液管将DMSO溶液从培养皿中分离出来是适合静态培养的。总的来说,我们描述的方法很容易实施,考虑到钙磷酸盐DNA共沉淀协议是将外来基因引入哺乳动物细胞的一种简单、经济的方式。实际上,自从Graham和Van der Eb在1973年报道这种方法用于转染腺病毒DNA和猴病毒40进入哺乳动物细胞以来,钙磷酸盐转染一直是引入基因的流行的方法之一。
对转染的HEK-293细胞使用10% DMSO进行5分钟处理,由此增加了约1.6倍的转染效率,这一效果很可能归因于DMSO分子提高膜渗透性的能力,通过渗透作用以及DMSO诱导的膜上磷脂头基的脱水作用。因此,更多的cDNA质粒能够进入细胞,或者通过内吞作用准确地被细胞摄取,并最终进入细胞核。然而,更高浓度的DMSO或更长时间的DMSO暴露具有细胞毒性。即使是较低浓度的DMSO,但长时间暴露或极端情况下,长期将DMSO培养在培养基中,也可能对细胞造成伤害。在这项研究中,我们展示了尽管将同一DMSO浓度(即10%)的暴露时间从5分钟延长到10分钟,并不会导致细胞计数降低,至少不会显著降低,但它确实导致了蛋白表达百分比的降低,正如GFP实验中所见。在这种情况下,蛋白质产量的减少,而不是细胞数量,可能归因于DMSO处理对转录的负面影响。DMSO的过度暴露可能会抑制细胞核糖体的功能。只要将暴露时间保持简短或精确地5分钟,这样的程序就可以在不损害细胞活性、细胞生长或在HEK-293细胞中表达的蛋白质的功能属性的情况下,产生更高的短暂转染产量。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57