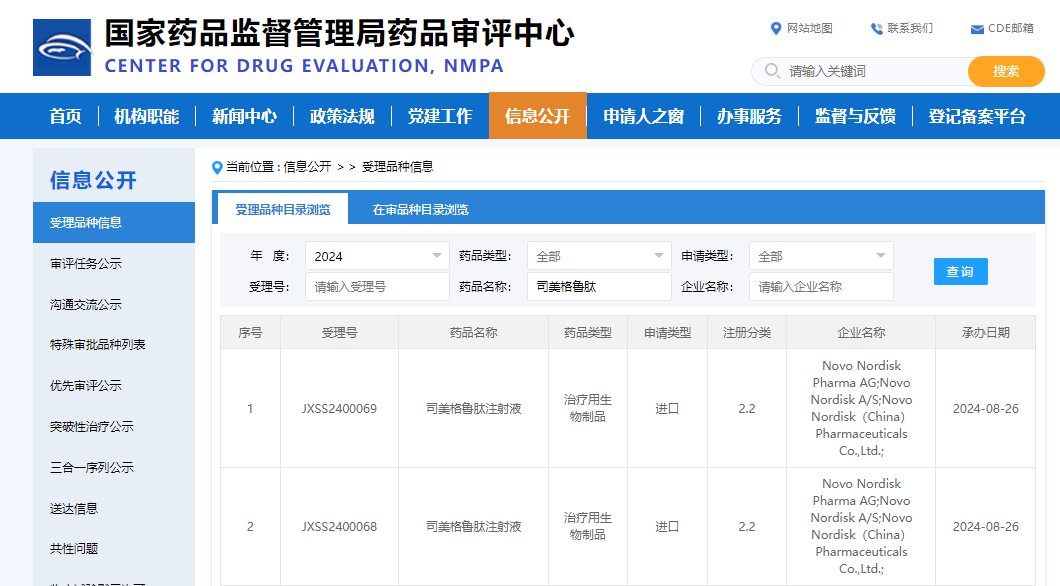
8月26日,从国家药品监督管理局药品审评中心(CDE)官网公示,诺和诺德重磅产品司美格鲁肽注射液新适应症上市申请获受理,结合既往诺和诺德公开信息及司美格鲁肽的临床研究进展,预测本次申报为慢性肾病(CKD)相关适应症。
从药渡数据检索可知,司美格鲁肽注射液最早于2017年12月作为2型糖尿病的治疗药物获FDA批准上市(商品名:Ozempic);2021年6月,FDA批准了司美格鲁肽作为减肥药上市(商品名:Wegovy);今年3月9日FDA再度批准了司美格鲁肽的全新适应症用于降低患有心血管疾病和肥胖或超重的成人心血管死亡、心脏病发作和中风的风险。
诺和诺德开展的FLOW研究是司美格鲁肽注射液1.0mg在糖尿病合并CKD患者中开展临床研究,临床结果在《新英格兰医学杂志(NEJM)》上发表。FLOW研究是一项双盲、随机、安慰剂对照的III期临床试验,共纳入3533名患者,旨在评估每周一次皮下注射的司美格鲁肽在预防主要复合终点事件(包括肾衰竭、肾功能大幅度下降以及肾性死亡或心血管死亡)方面的有效性和安全性。
研究结果表明,试验达成了主要研究终点:中位随访3.4年,司美格鲁肽组显著降低主要肾脏事件的风险达24%,且主要终点风险降低由各组分共同驱动,肾脏和心血管事件组分均有助于风险降低(如主要终点的亚组分析显示,基线年龄、性别、体质指数(BMI)、病程、估算肾小球滤过率(eGFR)、尿白蛋白肌酐比(UACR)、心血管病史、合并用药等不影响司美格鲁肽注射液的复合肾脏获益。
参考文献



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57