医麦客新闻 eMedClub News
在COVID-19疫情背景下,mRNA疫苗的快速崛起让RNA疗法成为全球关注的焦点。基于RNA的疫苗创下了历史上最快疫苗研发时间的记录,从开发到获FDA上市仅仅用时一年时间。发现了核苷碱基修饰的科学家更是凭此获得了2023年诺贝尔奖。
然而,mRNA疫苗在持久性和免疫原性等方面展现出的局限性,促使科学界积极寻求新的突破。正是这样的背景下,被誉为“mRNA 2.0”的环状RNA(circRNA)以其独特的优势被关注到。先进国际期刊Nature发文称“circRNA是RNA疗法的下一代重磅技术”。
前世今生——circRNA的发现
1976年,circRNA首次被发现,但当时被认为是细胞内mRNA剪接错误带来的副产物。2013年,Nature期刊同期发表了两篇研究论文,确立了circRNA是一类具有调控作用的非编码RNA,可以通过作为miRNA的海绵来调控其他基因表达。这让沉寂30多年的circRNA一鸣惊人,并陆续被发现在细胞分化、组织稳态、疾病发展,以及免疫代谢中发挥重要调节作用。
2018年7月,是circRNA发展史上的一个关键转折点,麻省理工学院(MIT)的 Daniel Anderson 等人在 Nature Communications 期刊发表论文,首次证实工程化的circRNA可在真核细胞中稳定、高效表达蛋白,开创了外源circRNA在真核细胞中表达蛋白的新应用,也证明了circRNA是线性mRNA的有效替代品。
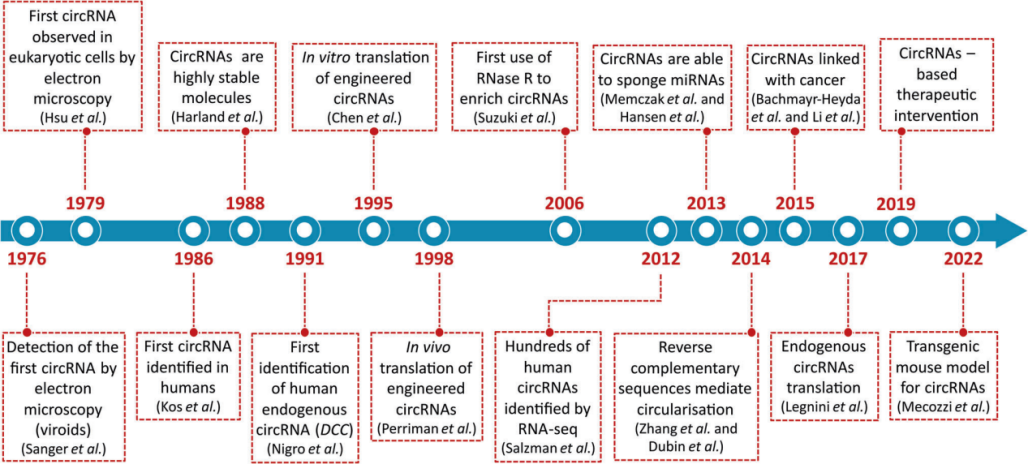
▲ circRNA研究的里程碑事件
异军突起——circRNA vs mRNA
线性mRNA疫苗虽然研发周期短且易于实现量产,但在RNA技术中有一个关键的缺陷,即其通常以线性形式存在,而这种形式存在的mRNA寿命很短。一般来说,在几个小时之内,细胞内的核酸酶就会将其降解掉。对于mRNA疫苗而言,其短暂的寿命并非什么大问题,因为RNA只需要很短的时间就能编码出蛋白质,从而引起免疫反应。
而对于大多数治疗来说,则需要让RNA停留足够长的时间才能具有更长的疗效。这时候就需要在合成时对其进行大量修饰,以抵抗细胞内核酸酶的降解及避免引起先天免疫刺激,然后再通过脂质纳米颗粒(LNP)递送。整个过程效率低下,且价格昂贵。即便如此,修饰后的线性mRNA的半衰期还是较短。
不同于线性mRNA,circRNA是一种独特的单链RNA分子,其最显著的特点在于其共价闭合的连续环形结构,原本在线性RNA分子中存在的3'和5'末端被巧妙地连接在一起,这与传统线性RNA截然不同。这一独特的环形结构赋予了circRNA诸多优势,不仅使其能够有效抵御核酸酶的降解,还显著提升了蛋白表达效率。同时,未修饰的circRNA具有较小的副作用,安全性能更高,且可以延长抗原递呈时间并保持长久的免疫反应,即使在低剂量水平,也可以增加其治病潜力,从而制造成本也大大降低。
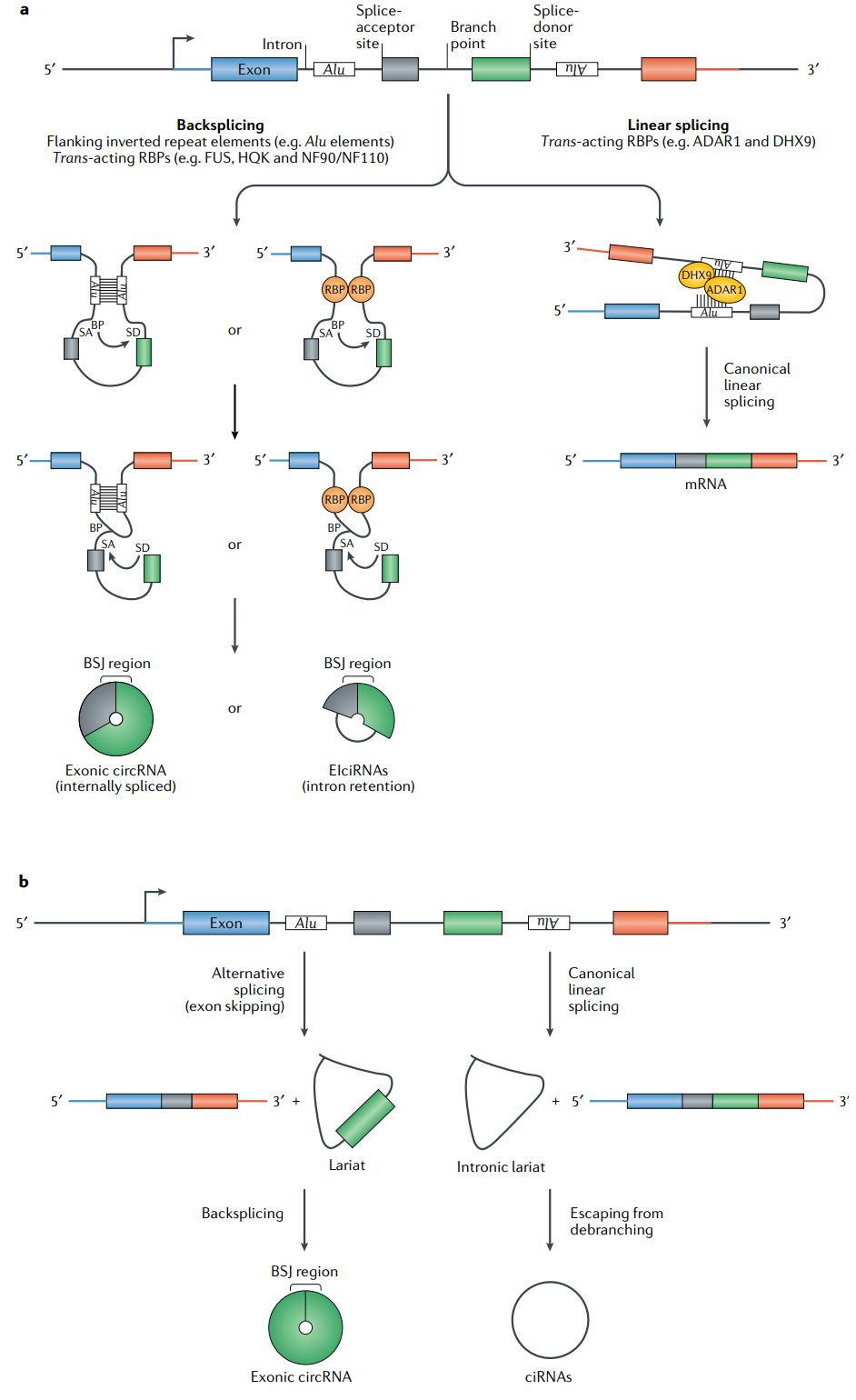
▲ circRNA的形成
递送策略上,circRNA的递送通常采用LNP、外泌体和病毒样颗粒。总体而言,目前circRNA的递送仍然广泛采用LNP系统。但LNP也存在一些不容忽视的缺点,比如具有肝脏积累的倾向,肝外应用受限等。外泌体和病毒样颗粒则具有更强的生物兼容性。
(关于外泌体如何赋能下一代CGT药物开发,亦诺微创始人兼CEO周国瑛博士将于2024 年 9 月 4 日,在艾本德联合医麦客、ATLATL飞镖创新研发中心举办的以“逐本未来,品质为先”为主题的沙龙活动--新一代 CGT 药物创享交流会上分享。欢迎扫码报名线上或线下参加。)
mRNA 2.0未来可期
1.潜在应用前景及挑战
circRNA作为下一代RNA疗法的核心,有望治疗各种难治性疾病,包括病毒性传染病、肿瘤、病原菌感染、自身免疫性疾病、代谢性疾病等。
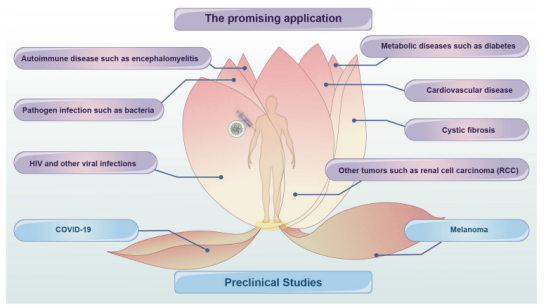
▲ circRNA的潜在应用
蛋白质替代疗法:其目的是恢复那些缺失或有缺陷的蛋白质功能,通常是由基因突变导致。采用mRNA治疗内源蛋白缺失已应用于多种疾病。相对于mRNA,circRNA结构具有更高的稳定性,蛋白质表达时间更长,从而可以产生较高的蛋白质累积并持续较长时间,减少给药频率,且免疫原性较低。
杜氏肌营养不良症(DMD),是由于 X 染色体上编码抗肌萎缩蛋白的基因突变所导致的遗传病,患者无法产生足够的抗肌萎缩蛋白。Orna Therapeutics公司发现了使用circRNA-LNP进行DMD的治疗,可以实现持久高效的蛋白表达,甚至是长编码区蛋白的表达,且编码全长抗肌萎缩蛋白和截短体的circRNA均能在原代骨骼肌细胞中表达。
疫苗:疫苗接种的目标是诱导强烈的适应性免疫反应和长期免疫记忆。适应性免疫记忆的诱导部分取决于抗原暴露的持续时间。与mRNA相比,circRNA固有的稳定性延长了蛋白质翻译的时间,增加了体内的蛋白质产量,长期表达抗原可以更有效地诱导具有持久免疫记忆的免疫反应。
近日,复旦大学基础医学院璩良等人发表了一篇文章,详细解析了通过注射编码HER2特异性肿瘤抗原的circRNA疫苗增强circRNA-CAR介导的巨噬细胞和T淋巴细胞的抗肿瘤效应。
癌症免疫疗法:采用机体免疫的作用成分如细胞因子、抗体和免疫细胞等进行癌症的治疗。circRNA在癌症免疫治疗领域展现出多重优势,包括其可用于肿瘤个性化治疗、高稳定性确保抗原蛋白的稳定表达,以及诱导更强的免疫反应。同时,circRNA固有的较低免疫原性对于肿瘤内免疫刺激蛋白表达更具优势。
细胞因子作为一类小型蛋白信号分子,已被证实具有增强抗肿瘤效果的能力。其中,白细胞介素-12(IL-12),作为细胞介导免疫的有效诱导剂,具有刺激活化 T 细胞和 NKT 细胞的效应功能,在肺癌等实体瘤中显示出良好的抗肿瘤作用。但由于它的脱靶毒性和给药方式的低效性,其应用受到限制。近日,多伦多大学李博文团队筛选出针对肺癌的H1L1A1B3 可电离脂质,将其整合进脂质纳米颗粒(LNPs)。然后利用这些纳米颗粒包封核酸,但包封的是 IL-12 circRNA,而不是IL-12 mRNA。将IL-12 circRNA 有效递送到肺部肿瘤,并联合免疫检查点抑制剂治疗(ICI),最终提高了肺癌免疫治疗的效果。
基因编辑:与mRNA相比,circRNA提供的稳定性和稳健表达可以使Cas9蛋白的持久性更长,增加的蛋白表达可能会显著提高基因编辑效率。
在ADARs介导的RNA编辑中,2022年,魏文胜课题组设计并运用了可招募ADAR的环形RNA(circ-arRNA),通过AAV递送,遗传编码的circ-arRNA可以在人的原代细胞和类器官中实现长时程的RNA编辑,这种可避免核酸外切酶切割的环状RNA进一步提升了体外和体内编辑的效率和精准性, 基本清除了双链RNA区域内目标转录本上的脱靶。
非编码环状RNA治疗:circRNA在细胞内具有内源性非编码功能,如miRNA和RNA结合蛋白海绵功能。circRNA作为调控RNA,具有作为miRNA和RNA结合蛋白的竞争性抑制剂从而进行治疗的潜力。
总的来说,circRNA 的潜力和市场的热情预示着其光明的前景,但其仍存在一些挑战。比如如何精准调控circRNA的表达水平,使其维持在适当的功能水平而不会过量表达导致毒性,还需要进一步开发;对 circRNA 修饰需要进行更深入的研究来进一步降低circRNA的免疫原性。同时,递送也是各应用的主要挑战之一。相信随着科研技术的不断进步,circRNA技术的持续改进有助于其更广泛的进入产业化阶段。
2.全球产业化布局
放眼全球,尽管这个赛道吸引了国内外企业纷纷布局,然而目前还未有真正的circRNA药物上市,所有在研管线都处于临床阶段,已入局的玩家几乎都是刚起步创业的生物医药公司。
同样,这个风口也被MNC盯上,布局该领域的新锐公司都从融资市场揽获了不小的支持。业内人士戏称,2021年堪称circRNA相关企业的融资元年。

Orna Therapeutics是全球首家利用circRNA技术开发新疗法的公司,主要项目是一种原位CAR疗法,它结合了circRNA分子和LNP技术,将CAR直接递送至患者体内的免疫细胞。据Orna Therapeutics官网所示,其主攻方向是利用circRNA的稳定性制备原位CAR-T。
另外,值得一提的是,Orna Therapeutics在人类细胞中实现了全长抗肌萎缩蛋白编码RNA的非病毒递送,以及在小鼠模型中实现了较小长度抗肌萎缩蛋白编码RNA的体内递送。
Orna Therapeutics成立于2019年,成立之初便获得了1000万美元种子轮资金,2021年完成了1亿美元的融资,截至2022年完成了2.21亿美元的B轮融资,并与默沙东达成了一项总资金为36.5亿美元的合作。

著名风投机构Flagship于2021年投资5000万美元创立了Laronde。Laronde同样布局circRNA赛道,其核心技术是自主研发的eRNA环化技术。成立仅3个月,Laronde就获得了4.4亿美元的B轮融资,是迄今为止circRNA公司获得的最大的一笔融资。
2023年,Laronde宣布和Flagship孵化的一家纳米载体Senda Biosciences合并成为一家新公司——Sail Biomedicines,将Laronde的环状RNA平台和Senda的可编程纳米颗粒平台结合起来,开启全面可编程的药物开发。

不仅是国际上布局circRNA的企业在疯狂吸金,国内不少企业也获得了大笔融资。以圆因生物为代表的circRNA新锐企业,与国际企业齐头并进,纷纷打造了各自的技术平台。
圆因生物是国内首家布局circRNA的企业,建立了体外高效制备高纯度circRNA的技术平台,针对新冠病毒及其变异株,设计了编码新冠病毒刺突蛋白RBD的circRNA疫苗。2021年和2022年,圆因生物分别完成了超亿元的Pre-A轮融资和2.8亿元人民币的A轮融资。

除此之外,2021年成立的环码生物也受到了资本的青睐,成为国内首家circRNA融资企业。截至目前,环码生物已经完成了A轮融资,预估累计融资金额近4千万美元。
环码生物拥有多项自主研发专利,如基于II型内含子自剪接核酶的活性可在体外环化任意RNA,其还建立了一套基于circRNA的高通量筛选系统可以高效筛选翻译起始元件,并为circRNA建立了基于人工智能的序列优化设计平台。
据悉,环码生物曾接连两度与MNC携手。2023年7月,环码生物与辉瑞就circRNA疗法达成研发合作协议。今年2月,环码生物宣布与BMS达成一项可行性研究合作。
此外,国内企业先博生物和国外circRNA领头羊Orna Therapeutics还达成了合作。除了上述几家企业之外,其他代表性的企业还有科锐迈德、博雅辑因、吉赛生物、博安生物等也已经形成了具有独特优势的技术平台。
在此背景之下,还有部分企业着眼于解决痛点、难点问题的核心专利技术上,如日前,艾博生物公布其自主研发的、拥有全球自主知识产权的高效RNA成环顺式剪接系统(Cis系统),突破了海外PIE系统专利的限制,有望成为高效制备高质量circRNA的突破性技术。放眼未来,本土创新想要避免发生“mRNA专利战”的前车之鉴,只有提早突破海外壁垒,才能有望在circRNA技术得到大规模应用之前,迅速抢占其带来的无限潜力和广阔的全球市场机遇。
总结
整体来说,circRNA赛道活力迸发,虽然整体尚处于早期阶段,但东风已至,天下已成大争之势。随着国内外企业持续深化circRNA布局,加速释放其潜力,以及技术的不断成熟,这种更稳定、低成本的新一代RNA疗法——circRNA,有望迅速崛起,站在mRNA这一“巨人”的肩膀上,成为下一个热门赛道。
参考资料:
1.各企业官网
2.https://mp.weixin.qq.com/s/_Oxyw8dDYDg2n4Gd_NhFiQ
3.https://mp.weixin.qq.com/s/O04zscDDROencxupwUkO2Q
4.https://mp.weixin.qq.com/s/Y_oqFYTRMdFkc0aHFUB8Hw
5.https://mp.weixin.qq.com/s/ZlgVrECiWNR9kijgF5fFbA



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57