磷脂酰丝氨酸(PS)是细胞膜中最丰富的带负电荷的磷脂,在细胞膜结构、细胞凋亡、血液凝固和病毒感染等生理过程中发挥关键作用。在哺乳动物细胞中,PS的生合成发生在内质网中,磷脂酰丝氨酸合成酶(包括PSS1和PSS2)通过钙离子依赖的方式利用丝氨酸将磷脂酰胆碱(PC)或磷脂酰乙醇胺(PE)的极性头基替换,生成PS。PSS1的功能获得性突变会显著增加PS的产量,并引起名为Lenz-Majewski综合症(LMS)的罕见遗传病。最新研究表明,PSS1特异性抑制剂在PTDSS2缺乏的癌症和B细胞淋巴瘤的治疗中显示出潜在的应用价值。
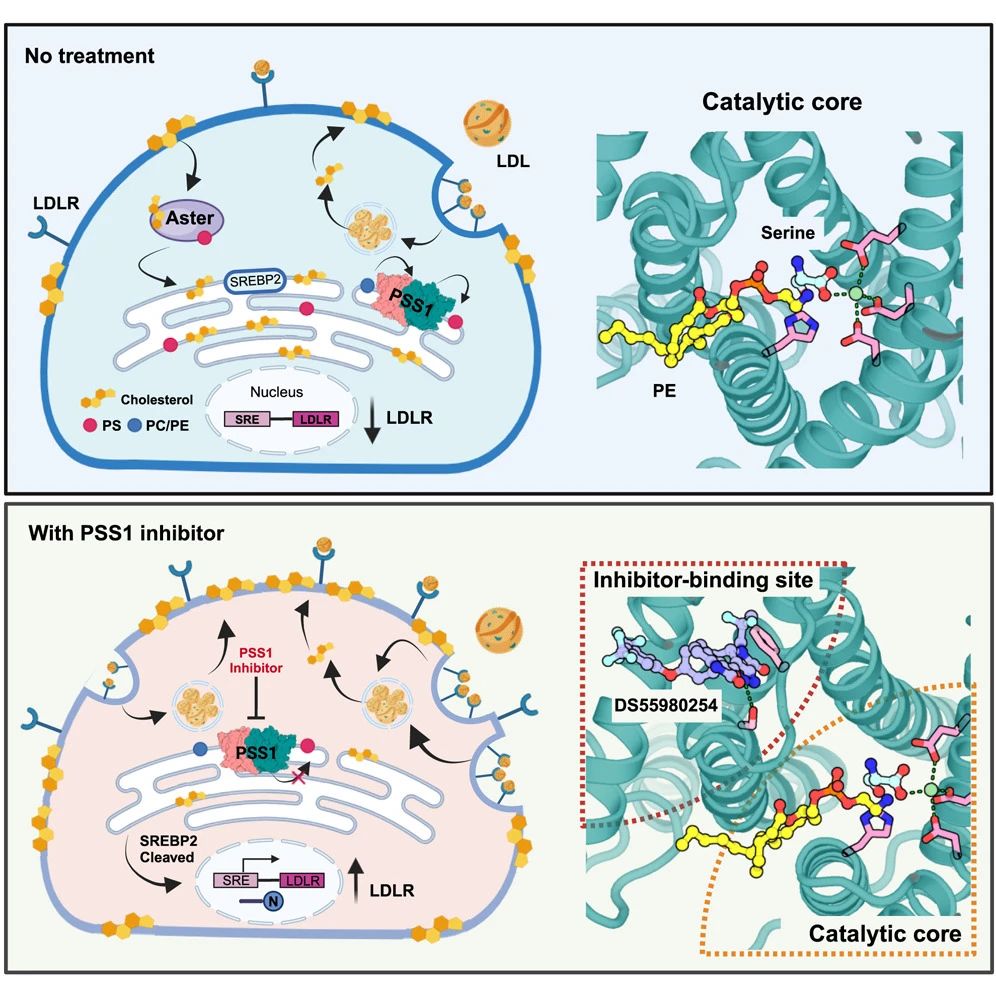
低密度脂肪蛋白(LDL)通常被称做“坏胆固醇”,LDL在血液中的积累会引发心脑血管疾病和中风。目前,关于治疗高血脂的药物主要作用在增加细胞表面的LDL受体,提高LDL的吸收来减少其在血液中的积累。2020年,1985年诺贝尔奖生理学或医学奖得主Mike Brown和Joe Goldstein的研究组发现,PSS1调控LDL中的胆固醇从细胞膜转运至内质网的过程,其缺失会导致胆固醇在细胞膜上的积累。然而,关于PSS1催化PS合成的分子机制、特异性抑制剂的作用机制以及其在LDL代谢调控中的作用仍然不明确。
2024年8月28日,德克萨斯大学大学西南医学中心李晓淳团队在 Cell 期刊发表了题为:Molecular insights into Human phosphatidylserine synthases 1 reveal its inhibition promotes LDL uptake 的研究论文。
该研究首次报告了人源PSS1的2.7 Å分辨率的冷冻电镜结构,揭示了哺乳动物中PS合成机理。细胞生物学研究进一步证明,特异性抑制PSS1活性可以增加细胞表面LDL受体的表达,从而促进LDL的吸收。该研究阐述了通过抑制磷脂代谢来控制LDL的吸收的概念,为开发新型降胆固醇药物提供了理论依据。

功能研究和分子动力学模拟表明,PS通过变构调节的方式抑制PSS1的催化活性。通过对LMS致病性功能获得性突变体P269S的结构分析表明,在无PS结合的情况下,PSS1会发生构象变化使得底物磷脂和丝氨酸更容易进入催化活性中心。进一步功能研究表明PSS1利用催化残基组氨酸来激活被钙离子稳定的丝氨酸来完成磷脂头的交换反应。这个反应机理与李晓淳团队发现的MBOAT家族的催化机制类似。
通过对PSS1与其特异性抑制剂DS55980254复合物结构的解析,研究团队观察到抑制剂结合在催化中心旁边的口袋。研究团队进一步揭示,PSS1缺失会导致内质网胆固醇浓度下降,从而激活SREBP-2途径。细胞实验表明PSS1抑制剂能够显著提高细胞表面LDLR的数量,从而促进LDL的摄取。与目前广泛应用于临床的他汀类药物不同,DS55980254不会抑制胆固醇合成酶羟甲基戊二酸单酰辅酶A(HMGCR)的活性,也不会导致HMGCR在内质网的积累,有可能避免他汀药物所产生的副作用。由于细胞中还广泛存在PSS2,特异性抑制PSS1的活性也不会导致细胞因PS缺失而死亡。
这些发现阐述了通过调控磷脂代谢来控制LDL吸收的概念,为开发新型降胆固醇药物提供了理论依据。
李晓淳研究组的龙韬博士和李栋宇博士为论文共同第一作者,龙韬博士将于下月入职武汉大学泰康医学院(基础医学院)开展独立研究。范德比尔特大学的杨中悦教授和姜姚煜坤博士进行了分子动力学模拟实验。西南医学中心分子遗传系的Philip Schmiege,Goncalo Vale和Jeffrey McDonald对该项研究亦有贡献。
https://www.cell.com/cell/abstract/S0092-8674(24)00895-X



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57