心力衰竭(HF)是全球发病率和死亡率的主要原因,尽管血运重建技术和医疗护理的进步已大大降低了急性心肌梗死(MI)的死亡率,但缺血性心肌病的发病率却在增加。心力衰竭的发病机制与慢性炎症过程错综复杂地相关,导致心肌细胞(CM)不可逆损失。虽然短暂的炎症对于心脏修复至关重要,但适应不良的免疫反应会导致不良的左心室重构和慢性心力衰竭的发展。在急性心肌梗死后使用免疫调节药物改善心脏功能的想法已在多项临床试验中进行了测试,但结果却相互矛盾。
在显示出有希望的结果的药物中,有特异性靶向IL-1β的卡那单抗(Canakinumab)和具有广泛抗炎作用的秋水 仙碱。然而,感染相关死亡风险的增加以及这些药物的成本效益可能会阻止它们成为常规护理的一部分。
新药开发是一个费力、长期且昂贵的过程。因此,重新利用已批准的药物来治疗新的适应症,是扩大治疗手段以治疗患者的一个有吸引力的策略。
2024年8月26日,以色列魏兹曼科学研究学院的研究人员在 Nature 子刊 Nature Cardiovascular Research 上发表了题为:Repurposing of glatiramer acetate to treat cardiac ischemia in rodent models 的研究论文。
该研究表明,常用于治疗多发性硬化症的药物醋酸格拉替雷(Glatiramer-acetate)可在小鼠和大鼠中修复心脏病发作或心力衰竭后的心脏损伤。

醋酸格拉替雷(Glatiramer-acetate)是一种由四种氨基酸组成的合成无规共聚物,多年来一直用于治疗多发性硬化症(MS)。最初,GA被设计成类似于自身抗原髓鞘碱性蛋白,并在多发性硬化症的动物模型中具有有益效果,然而,多项研究揭示了其广泛的免疫调节和抗炎作用机制,影响先天和适应性免疫反应。GA随意地与主要组织相容性复合体(MHC)分子结合,同时作为MHC阻断剂和T细胞受体拮抗剂,导致病理效应功能受到抑制。GA还被证明能够调节树突状细胞和单核细胞,优先刺激2型辅助T细胞(TH2)样反应,诱导抗炎细胞因子的分泌和调节性T细胞(Treg)的升高,从而增强修复过程。有趣的是,这些活性独立于GA的髓鞘模拟特性和MHC阻断活性。
基于其广泛的免疫调节作用模式,研究显示了其在其他疾病模型中的有益效果。由于GA的免疫调节作用机制、其在各种病理系统中的疗效以及广泛的安全性,研究团队推测它可能减轻与心肌损伤相关的病理炎症过程,从而防止其进展并改善心脏结局。
在这项最新研究中,研究团队利用急性心肌缺血小鼠模型启动了GA用于治疗心脏病的药物再利用过程。结果显示,GA治疗对心脏损伤的有益多效性作用,表现为心脏功能改善和疤痕面积减少。对GA作用模式的检查表明,除了其已知的免疫调节作用(在此心肌炎症的背景下显示)外,它还促进了心肌细胞免受缺血诱导的死亡,减少了纤维化并增强了血管生成,体外和离体实验证明了基质细胞对心肌细胞的旁分泌作用。此外,在心力衰竭大鼠模型中进行的短暂GA治疗,导致左心室收缩功能改善,从而改善了心脏泵血能力,并抑制了间质纤维化的进展,进一步证实了GA的心脏保护益处。
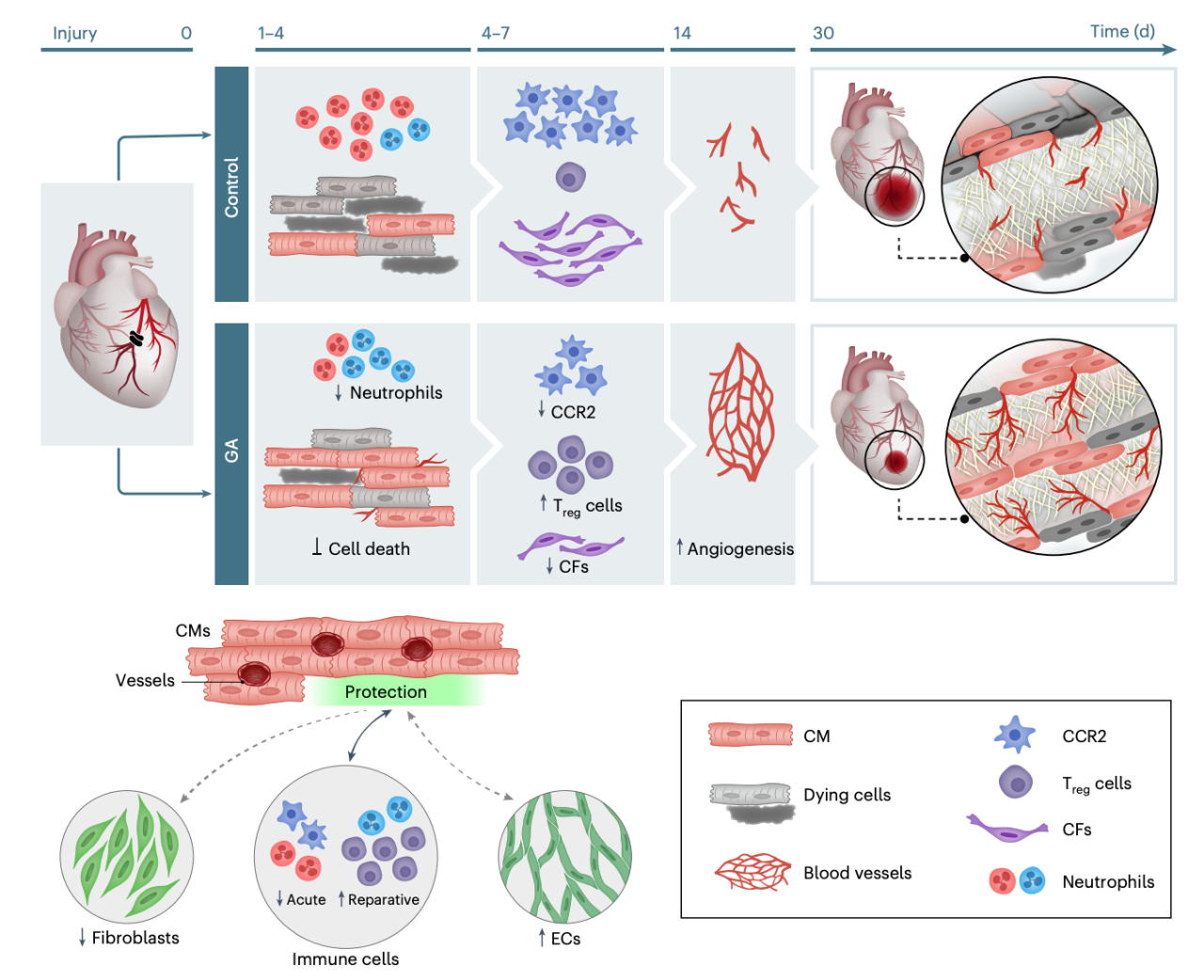
GA对损伤心脏的多效有益作用模式
总的来说,该研究揭示了醋酸格拉替雷(Glatiramer-acetate)在啮齿动物心脏缺血模型中的保护和修复作用,并强调了将GA作为心脏病治疗方法的潜力。
论文链接:
https://www.nature.com/articles/s44161-024-00524-x



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57