Merus公司于2024年12月5日宣布,其研发的生物药物Bizengri(Zenocutuzumab)已获得美国食品药品监督管理局(FDA)的生物制品许可申请(BLA)批准,用于治疗携带神经调节蛋白1(NRG1)融合基因的非小细胞肺癌(NSCLC)和胰腺导管腺癌(PDAC)患者。值得注意的是,Zenocutuzumab不仅是全球首个获批的HER2与HER3双重靶向抗体,也是FDA首次批准的专门针对NRG1融合阳性的晚期不可切除或转移性PDAC和NSCLC的治疗方案。

截图来源:Merus 公司官网
神经调节蛋白1(NRG1)是一种与人类表皮生长因子受体(HER)3结合的配体,能够促进HER2/HER3异源二聚体的形成和致癌作用,进而导致肿瘤的增长。NRG1与伴侣基因的融合是一种罕见的致癌基因组事件,它出现在某些类型的癌症中,包括NSCLC和PDAC。对于NRG1融合阳性(NRG1+)的癌症患者而言,治疗选择相对有限。Zenocutuzumab作为一种双特异性抗体,能够与HER2和HER3的细胞外结构域结合,通过阻断NRG1/HER3的相互作用和HER2/HER3的二聚化,进而抑制肿瘤细胞通过PI3KAKT-mTOR致癌信号通路的增殖和存活。
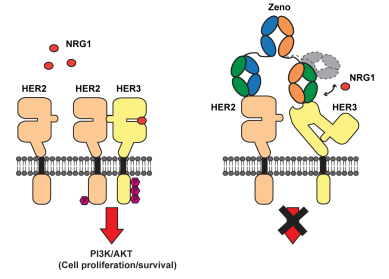
截图来源:Merus 公司官网
临床前研究显示,Zenocutuzumab在多种NRG1+癌症模型中,包括NRG1+ NSCLC和NRG1+ PDAC,均表现出了显著的抗肿瘤活性。此前,FDA已授予Zenocutuzumab优先审评资格和突破性疗法认定,用于治疗晚期不可切除或转移性NRG1+ PDAC和NSCLC。此次批准是基于1/2期eNRGy试验的数据,该试验旨在评估Zenocutuzumab单药疗法在NRG1+ NSCLC、PDAC和其他实体瘤中的安全性和抗肿瘤活性。试验数据显示:
在NRG1+ PDAC患者(n=30)中,客观缓解率(ORR)为40%,持续缓解时间(DOR)范围从3.7个月到16.6个月不等。
在NRG1+ NSCLC患者(n=64)中,ORR为33%,中位DOR为7.4个月。
Merus是一家致力于开发创新全长人类双特异性和三特异性抗体疗法的肿瘤学公司,Zenocutuzumab是其首个获批上市的药物。公司其他在研产品还包括针对EGFR × LGR5、EGFR × c-MET、CD137 × PD-L1、PD-1 × CD3、LAG3 × PD-1、TGFBr2 × PD-1等靶点的双特异性抗体。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57