乳腺癌是女性最常见的癌症,据世界卫生组织国际癌症研究机构(IARC)的最新评估数据,2022年全世界女性乳腺癌新增 231 万例,新增死亡病例 67 万例。
雌激素受体(ER 或 ERα)是一种核激素受体,驱动着大多数乳腺癌的发生,其内在无序的 N 端转录激活结构域(NTD)内的第 118 位丝氨酸通常会因磷酸化修饰(pSer118)而被激活。这种修饰会是雌激素非依赖性雌激素受体功能得以实现,靶向该结构域的激酶抑制剂正在进行临床试验,然而,这种磷酸化修饰驱动激活的机制,目前仍不清楚。
2025年1月8日,凯斯西储大学医学院杨泗春团队在 Nature 期刊发表了题为:The sequence–structure–function relationship of intrinsic ERα disorder 的研究论文。
该研究揭示了雌激素受体内在无序的序列-结构-功能关系,为靶向雌激素受体的乳腺癌药物开发开辟了新方向。

乳腺癌是全球女性癌症相关死亡的主要原因,其主要类型为雌激素受体阳性(ER+)。
雌激素受体(ER)第 118 位丝氨酸的磷酸化修饰(pSer118)由 MAPK2 或 CDK7 引起,可使雌激素受体在无配体的情况下被激活。尽管靶向这种磷酸化的 CDK7 抑制剂在临床试验中已显示出治疗前景,但磷酸化驱动激活的机制基础,目前仍不清楚。
在这项研究中,研究团队发现,pSer118 通过破坏富含芳香族氨基酸簇之间的疏水相互作用来驱动构象变化,展示了疏水性突变如何恢复雌激素受体介导的转录。
雌激素受体通过两个不同的结构域发挥作用:一个为内在无序的 N 端转录激活结构域(NTD),另一个为结构折叠的 C 端配体结合结构域(LBD)。虽然抗雌激素药物以 LBD 为靶点,但持续的 pSer118 可维持雌激素受体活性。这种耐药机制促进了 CDK7 抑制剂的开发,然而,与直接的雄激素受体 NTD 抑制剂不同,目前的 CDK7 抑制剂间接影响 ER-NTD。
目前的结构生物学技术,例如冷冻电镜和 AlphaFold 等计算工具,都不能有效地表征这些紊乱的结构域,有限的生物物理数据限制了我们对磷酸化触发激活的理解。
在这项最新研究中,研究团队通过将小角 X 射线散射和核磁共振光谱学与功能研究相结合,发现 pSer118 化会引发无序结构域的意外扩展,并破坏两个富含芳香族氨基酸区域之间的特定疏水簇集。也就是说,pSer118 通过破坏特异性疏水作用而不是静电作用,来调控雌激素受体活性,模拟这种破坏的突变可恢复因 S118A 磷酸化缺陷突变而受损的雌激素受体转录活性、靶基因表达和细胞生长。
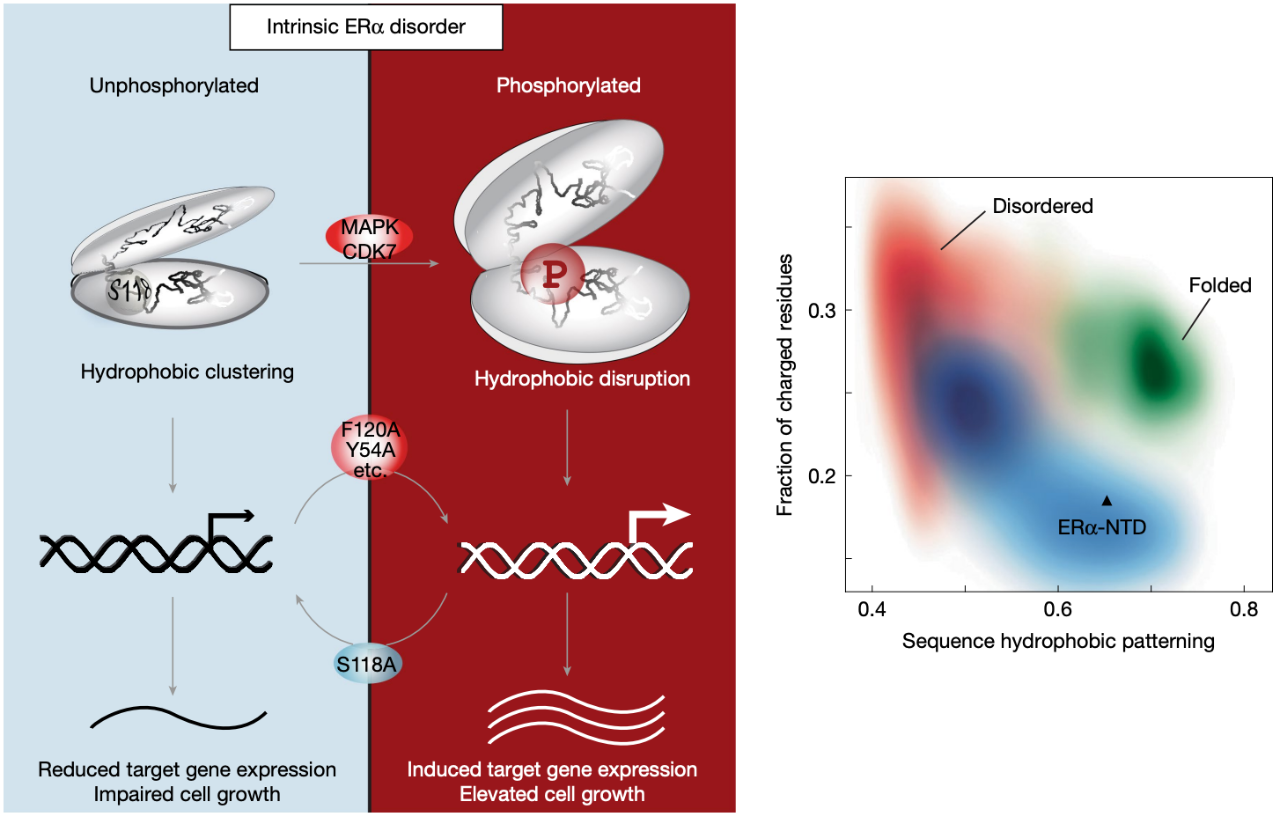
总的来说,这些由疏水相互作用驱动的发现,超越了传统认为的蛋白质磷酸化主要通过静电作用的调控模型,为内在无序蛋白质提供了机制上的见解,并对其他核受体具有重要意义。这种内在序列-结构-功能关系有助于我们理解雌激素受体的内在无序性,这对于开发有针对性的乳腺癌疗法至关重要。
论文链接:https://www.nature.com/articles/s41586-024-08400-1



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57