Protein A 亲和层析是一种高效且特异性强的纯化技术,广泛应用于单克隆抗体(mAb)及具有Fc结构域的分子如融合蛋白和双特异性抗体的捕获。然而,传统的Protein A 亲和层析在洗脱过程中需要使用低pH(3.0-4.0),这不仅可能导致对低pH敏感的分子产物降解,例如碎片化、聚集等,而且对产品的稳定性和质量产生不利影响。
为了解决这一问题,研究人员开发了新型的Protein A 填料,其配基设计经过优化,能够在较温和的pH条件下实现洗脱。例如,Purolite公司推出的Praesto Jetted A50 HipH填料,通过对其Fc和VH3结合区的序列进行修改,使其能够在pH 4.6或更高的条件下洗脱Fc融合蛋白和大多数mAb。优化后的洗脱和洗涤条件不仅实现了高回收率(>90%单体收率),还显著减少了高分子量(HMW)物质(>50%),并在尽可能温和的洗脱pH下有效清除了宿主细胞蛋白(HCP)。
对于pH稳定的mAb和pH敏感的融合蛋白,在优化条件下进行细胞培养物料的纯化,结果表明,温和洗脱pH填料能够以可接受的收率纯化产物,杂质清除率相当或更好,且与传统填料相比,天然洗脱液pH明显更温和。特别是在pH敏感蛋白的纯化中,优势更加明显,使用温和洗脱缓冲液和天然洗脱pH,洗脱液中HMW含量在48小时内仅有2%保持稳定。而传统需要低pH洗脱的Protein A填料,洗脱液HMW水平则为8%,在相同保持时间内增加到16%。
此外,这些新型填料还具有高动态结合载量,并允许使用传统的HCP洗涤方法。因此,Praesto Jetted A50 HipH填料成为平台Protein A填料的理想候选者,为pH敏感蛋白和稳定的mAb提供了更大的灵活性,同时确保了产物质量、收率以及与下游工艺的无缝集成。
亮点
ProA 配基的 Fc 和VH3 结合区的修改可以允许温和的洗脱 pH。
Jetted A50 HipH 可以在 pH 4.6 或以上时洗脱含 Fc 的蛋白质。
可以实现温和的洗脱 pH 值并实现高收率以及 >50% 的 HMW 减少率。
pH敏感蛋白质可以在稳定的pH区域内洗脱,并且随时间保持稳定。
Jetted A50 HipH 是一种适用于稳定和不稳定蛋白质的灵活平台 ProA 填料。
简介
自20世纪80年代以来,抗体及其相关产品的市场经历了显著的增长,逐渐成为生物制药领域中的主导产品类别。这一增长趋势不仅推动了对这些产品需求的不断攀升,也促使上游和下游工艺技术迅速发展,以满足日益增长的市场需求。
在单克隆抗体(mAb)或Fc融合蛋白的纯化过程中,Protein A亲和层析作为一种关键的初步捕获步骤,被广泛应用于从细胞培养收获物中分离目标产物。该技术利用来自金黄色葡萄球菌或大肠杆菌的天然或重组Protein A配基,将其与基质偶联,以实现对目标分子的特异性结合。
天然Protein A由五个同源结构域(E、D、A、B和C)组成,这些结构域均能与免疫球蛋白G(IgG)的Fc区发生相互作用,尤其对IgG1、IgG2和IgG4亚型表现出较强的亲和力。由于Protein A填料具有高选择性和结合亲和力,它们在蛋白质纯化过程中被广泛应用于含Fc分子的平台方法中,成为不可或缺的一部分。
为了进一步提升Protein A填料的性能,多年来研究人员通过工程改造Protein A配基或填料基质,做出了诸多努力和改进。这些改造主要集中在提高填料的结合载量和碱稳定性方面,以满足工业生产中对高效率和高纯度蛋白质纯化的需求。通过这些不断的技术创新和优化,Protein A亲和层析技术得以在生物制药领域持续发挥其重要作用,为抗体和抗体相关产品的生产提供了有力支持。
在生物制药领域,Protein A填料是单克隆抗体(mAb)纯化过程中不可或缺的工具,其通过与抗体的Fc区域特异性结合,实现高效的捕获和纯化。然而,对于Fc融合蛋白等对低pH敏感的蛋白质,传统的Protein A填料在低pH洗脱条件下可能会导致蛋白质聚集,增加免疫原性风险,影响药物的安全性和有效性。因此,开发新型的Protein A填料或优化纯化工艺,以降低低pH敏感蛋白质的聚集风险,对于提高Fc融合蛋白等药物的生产质量和效率具有重要意义。
研究表明,在洗脱缓冲液中添加稳定剂或采用提高洗脱pH值的策略,例如使用高浓度的氯化钠、氯化镁或精氨酸溶液,可有效抑制聚体的形成。然而,为了与后续的精纯步骤更好地衔接,通常需要额外的步骤来去除这些添加物,以达到预期的效果。
针对对低pH敏感的分子,一种Protein A层析的策略是直接中和洗脱液,以减少其在低pH条件下的暴露时间,从而大程度地降低聚体的形成。这需要在收集容器中预先准备好适量的中和缓冲液,以便洗脱液一加入即被中和。中和缓冲液与洗脱液的准确体积和比例至关重要,以确保洗脱液的pH值迅速进入分子稳定的范围。这种策略可以有效减少蛋白质聚集,使得传统的Protein A层析可用于纯化低pH敏感分子。然而,该方法需要精确控制,以确保在大规模生产中能够快速且充分地混合,这增加了工艺的复杂度。此外,该工艺的稳定性和灵活性较差,因为必须根据预定的洗脱体积提前制备中和缓冲液体积。对于那些在低pH洗脱过程中容易在柱上快速聚集的分子,该策略的应用也受到限制。
为了应对纯化pH敏感抗体和Fc融合蛋白所面临的挑战,Repligen与Navigo Proteins合作,开发出了一种新型的Protein A原型填料,该填料具备在较温和的pH条件下进行洗脱的能力。具体来说,研究人员通过对五个Protein A野生型结构域的序列片段进行重组,创造出全新的Protein A样序列,从而制备出一种“人造”的马赛克式Protein A等价物。此外,通过在不同位置引入定点突变,构建了一个小型的突变库,并从中筛选出具有更优洗脱pH特性的配基。实验结果表明,将野生型氨基酸替换为组氨酸可以最有效地提高洗脱pH。由于这些序列修改发生在Protein A分子的Fc和VH3结合区内,因此与野生型序列相比,在较温和的酸性pH下,其结合亲和力有所降低,但保留了在中性pH下的Fc结合亲和力,以促进产物的结合。通过筛选过程,研究人员确定了数种能够在较温和pH下洗脱的Protein A配基候选物。最终,选择了两种配基作为主要候选配基,它们均能在较温和的pH下实现洗脱,同时保持较高的结合载量。尽管Protein A的主要结合活性是通过抗体的Fc部分实现的,但它也能以不同的模式与VH3结构域结合。这两种候选配基在与抗体VH3结构域结合的能力上存在差异:其中一种候选配基仅对非VH3抗体表现出温和的洗脱能力,而另一种候选配基则在VH3结合区含有额外的氨基酸突变,使其对VH3和非VH3抗体均具有温和的洗脱能力。利用这两种主要候选配基,研究人员制备了两种原型填料,并对其性能进行了评估,相关结果详见本文。
随后,Repligen和Navigo Proteins与Purolite合作,致力于将该原型填料进行放大和商业化。该原型填料能够对VH3和非VH3抗体均实现温和的洗脱,并最终被商业化为Praesto® Jetted A50 HipH填料。Praesto® Jetted A50 HipH填料结合了Repligen的NGL-Impact A HipH配基,并采用了Purolite的喷射技术制造的Jetted A50基础基质。
随着抗体相关候选药物组合的日益多样化,对Protein A层析过程中更灵活的洗脱条件的需求也在不断增长。在本研究中,我们对两种专为较温和pH洗脱设计的Protein A填料(Jetted A50 HipH和原型HipH-002)进行了评估,并将其与两种广泛使用的商用Protein A填料(Jetted A50和MabSelect SuRe)进行了比较,主要考察了它们的洗脱pH、动态结合载量(DBC)以及杂质去除能力。此外,我们还通过稳定性研究,检验了洗脱pH对pH敏感分子的影响。
详细的实验操作和结果,请参考原文。
实验中使用的填料的性质

结果
脉冲注射实验
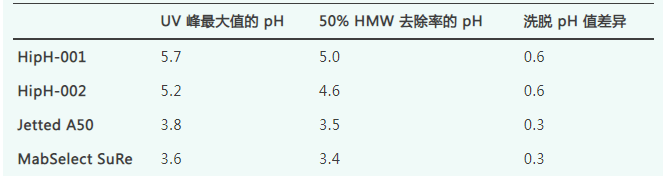
对表中列出的四种 Protein A 填料进行脉冲进样,然后以 pH 7.0 至 3.0 的线性 pH梯度进行洗脱。如图 1、图 2所示,对于所有测试的分子,Jetted A50 HipH 和 HipH-002 填料的洗脱 pH 明显高于现有的 Protein A 填料(Jetted A50 和 MabSelect SuRe)。
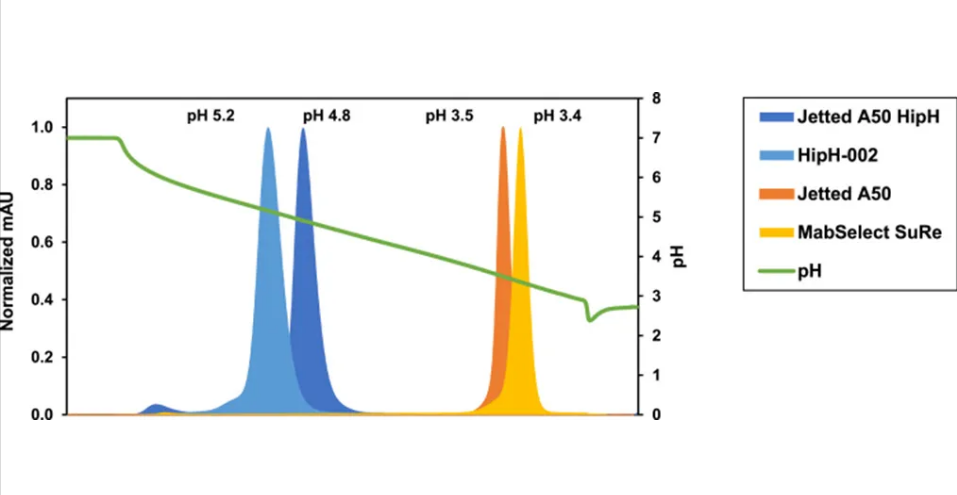
图 1.Protein A 填料上 Fc1 的洗脱 pH 值,定义为 UV 峰最大值的pH 值,通过 pH 7.0 至 3.0 的线性 pH 梯度脉冲注射确定。
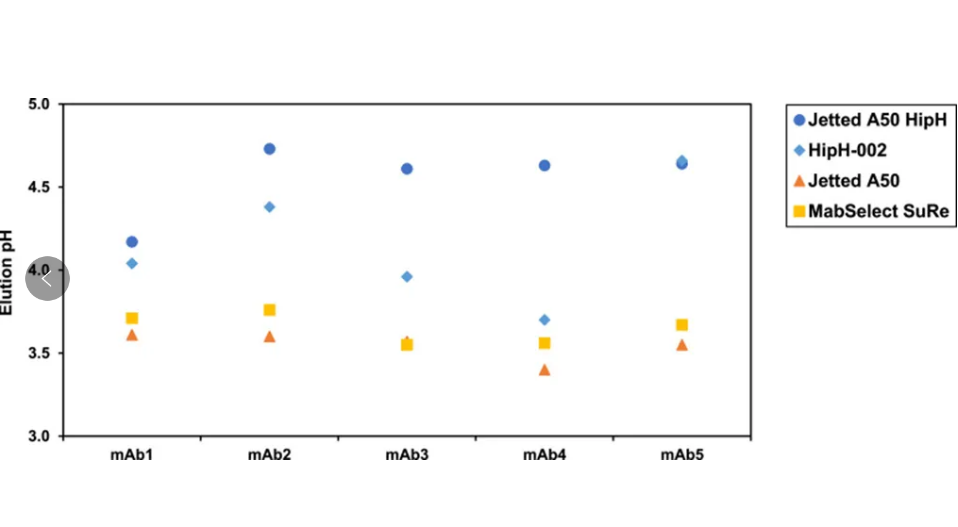
图 2. 5种mAb 在Protein A 填料上的洗脱 pH 值比较(定义为 UV 峰最大值的 pH 值),通过pH 7.0 至 3.0 的线性 pH 梯度脉冲注射确定。
图 1显示了线性 pH 梯度上 Fc1 洗脱曲线的 UV 轨迹。对于Fc1,在填料 Jetted A50 HipH 和HipH-002 上,洗脱峰最大值时的 pH 分别为 4.8 和 5.2。传统Protein A 填料Jetted A50 和 MabSelect SuRe 的峰最大值分别为 pH 3.5 和 3.4。Fc1 是一种 Fc 融合蛋白,据观察,在 pH 4.5 以下时聚体形成增加。使用传统Protein A 填料时,需要低 pH 缓冲液来洗脱 Fc1,并且需要直接中和策略来最大限度地减少分子在低 pH 条件下的暴露时间。相比之下,本研究中评估的 HipH 填料提供了明显更高的洗脱 pH,这使得可以直接回收稳定 pH 区域(> pH 4.5)内的 Fc1。
图 2总结了所评估的5种 mAb 的洗脱 pH。对于所有分子,传统Protein A 填料始终在 pH 3.4–3.7 下洗脱,表明需要低 pH 值才能打破 mAb 与传统Protein A 配基之间的相互作用。Jetted A50 HipH 对mAb 2–5 显示出非常一致的温和洗脱 pH,洗脱峰最大值在pH 4.6 和 4.7 之间。研究中的一个例外是 mAb1,其洗脱峰最大值发生在 pH 4.2。这种差异可能归因于 mAb1 的序列或结构,这导致 mAb 与 Jetted A50 HipH 配基之间产生更强的结合相互作用。HippH-002 对测试的 mAb 具有更多可变的洗脱 pH,洗脱峰最大值范围为 pH 3.7 至 4.7。与 Jetted A50 HipH 填料相比,mAb 2、3 和 4 在 HipH-002 填料上的洗脱 pH 值较低,表明与 HipH-002 配基的结合亲和力更强。这归因于 HipH-002 配基的 VH3 结合亲和力,因为这三种 mAb 均源自人 VH3 家族。此外,不同的 VH3 序列可能导致对相同配基的不同亲和力,这可以解释 mAb 2、3 和 4 在 HipH-002 上的洗脱pH 值差异。源自人 VH1 家族的 mAb 1 和 mAb 5 在 Jetted A50 HipH和 HipH-002 上具有相似的洗脱 pH 值。
实验结果表明,由于对Jetted A50 HipH和HipH-002配基进行了序列上的改良,这两种填料均能在比传统填料更温和的pH条件下实现洗脱。原型HipH-002配基仅对非VH3抗体表现出稳定的洗脱性能,这是因为其对VH3区域的结合亲和力可能因特定VH3序列的不同而存在更宽的洗脱pH范围。相比之下,Jetted A50 HipH是一种更为通用的温和洗脱pH填料,适用于所有含Fc的蛋白质,不受IgG类型或VH家族的限制。由于Jetted A50 HipH配基在VH3结合区引入了额外的突变,使其能够温和地洗脱VH3和非VH3抗体,因此与传统Protein A填料相比,预计所有含Fc的蛋白质都可以在更温和的洗脱pH下实现洗脱。然而,对于每种目标蛋白质,仍需进行实际实验以了解其具体的洗脱行为。在本研究中评估的6种蛋白质中,有5种在pH 4.6以上从Jetted A50 HipH中洗脱,而所有蛋白质均在pH 4.2以上洗脱。相比之下,Pabst等人评估了9种分子在12种市售传统Protein A填料上的洗脱pH行为,发现大多数蛋白质-填料组合的洗脱pH范围为3.5-3.8。对于传统Protein A填料而言,Fc结合亲和力仅在低pH条件下(如<pH 4.0)降低,蛋白质也只能在此pH以下洗脱。而HipH配基的修饰序列则在较温和的酸性pH下降低了Fc结合亲和力,从而允许在更温和的pH条件下实现洗脱。
动态结合载量
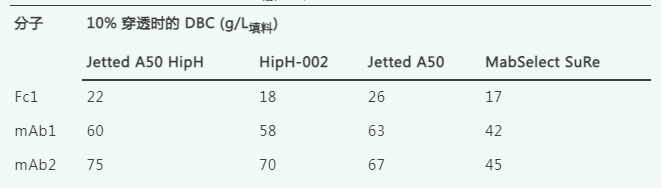
在6分钟的保留时间内,使用四种Protein A填料测定了mAb1、mAb2和Fc1在10%穿透时的动态结合载量(DBC)。表3总结了这三种分子在四种填料上获得的DBC值。由于Fc1的分子量大约是典型单克隆抗体的一半,因此其每单位体积填料的蛋白质质量动态结合载量预期较低。对于Fc1,Jetted A50 HipH和HipH-002的结合载量介于MabSelect SuRe和Jetted A50之间。需要注意的是,由于每种融合分子的设计都是独特的,因此这些数据可能无法预测其他Fc融合蛋白的性能。对于mAb1和mAb2,Jetted A50 HipH和HipH-002展现出与Jetted A50相当的高动态结合载量,且比MabSelect SuRe的动态结合载量高出40-70%。这一结果在意料之中,因为HipH填料与Jetted A50共享相同的基础填料基球。
表3.4种 Protein A 填料上 mAb 和Fc 融合蛋白的动态结合载量。
高分子量(HMW)馏分的梯度洗脱实验
尽管Protein A层析通常不降低高分子量(HMW)杂质的水平,但先前的研究指出,通过线性pH梯度洗脱可以实现聚体和单体的分离,因为聚体对配基的亲和力更强。然而,在传统Protein A填料上,找到一个稳定的操作空间以选择性地洗脱单体是非常具有挑战性的。
图3展示了四种Protein A填料在20个柱体积(CV)洗脱梯度过程中,Fc1的紫外(UV)吸收轨迹,其中pH值逐渐降低。色谱图上叠加的图表显示了各馏分中收集的累积高分子量(HMW)杂质回收率。对于所有四种Protein A填料,UV轨迹上均出现了一个后肩,表明后续馏分中含有较高比例的HMW杂质,这说明HMW杂质与填料的结合更为牢固,需要更低的pH值才能实现洗脱。由于HipH填料能够在较温和的pH条件下实现洗脱,因此与现有的Protein A填料相比,其在单体和聚体的分离度上表现得更为出色。表4比较了UV峰最大值出现时的pH值(代表大多数蛋白质洗脱的位置)以及实现50% HMW杂质去除的pH值,后者相当于累积HMW杂质回收率达到50%。在这两个pH值之间进行洗脱,可以在获得高蛋白质回收率的同时,实现超过50%的HMW杂质去除率。对于HipH填料,UV峰最大值和50% HMW杂质去除率之间的pH差异为0.6个pH单位,而传统填料的pH差异仅为0.3个pH单位。HipH填料的pH差异较大,表明单体与聚体之间的结合亲和力差异更为显著,从而为提高该纯化步骤的纯度提供了更大的操作空间。
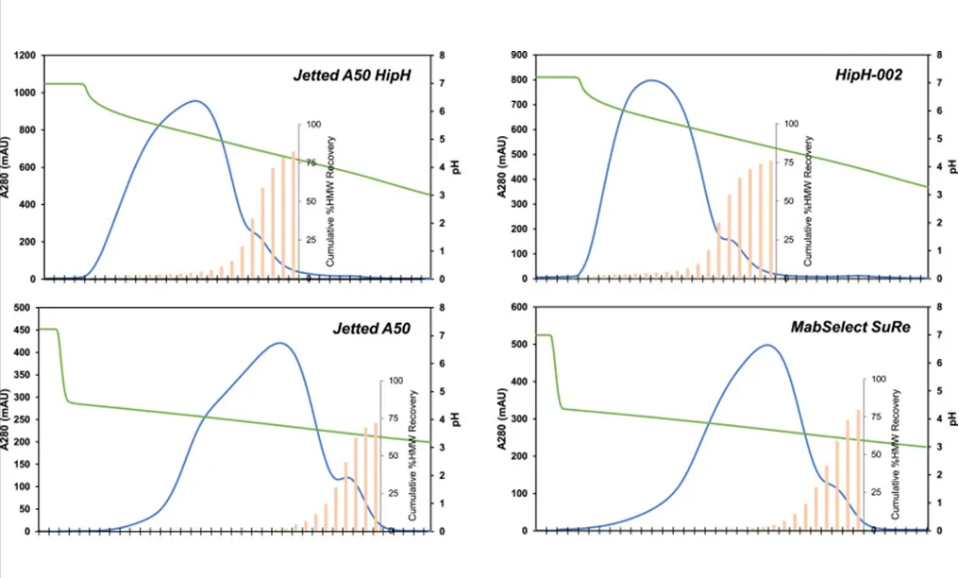
图 3. Protein A 填料上 Fc1 的紫外吸光度和累积 HMW 回收率。所有运行均采用 20 CV 下降线性梯度,Jetted A50 HipH 和 HipH-002 从 pH 7.0 下降至 3.0,Jetted A50 和MabSelect SuRe 从 pH 4.5 下降至 3.0。收集馏分以测量每个馏分中的 HMW 水平,并计算与上样中的 HMW 相比的累积洗脱 HMW。
表4. 在4种Protein A 填料上使用线性梯度分离 HMW。
较温和的洗脱pH填料为洗脱条件提供了更宽的操作范围,从而使得在Protein A层析过程中能更有效地去除高分子量(HMW)杂质。洗脱pH可根据分子特性进一步优化,以在收率和HMW杂质去除之间达到最佳平衡。在Protein A捕获步骤中显著降低HMW杂质含量,可减轻后续精纯步骤的杂质去除压力,进而提升整个下游工艺的效率。
等度洗脱评价
根据线性梯度上 mAb1 和 Fc1 的洗脱峰最大 pH 值,对它们进行了等度洗脱运行,评估了几种不同的洗脱 pH 值。每次运行的载量为 DBC 载量的 85%,穿透率为 10%。
图 4总结了等度洗脱实验中的单体收率和洗脱液 HMW 结果。图中显示的是单体收率,而不是总收率,以考虑被去除的聚体量。
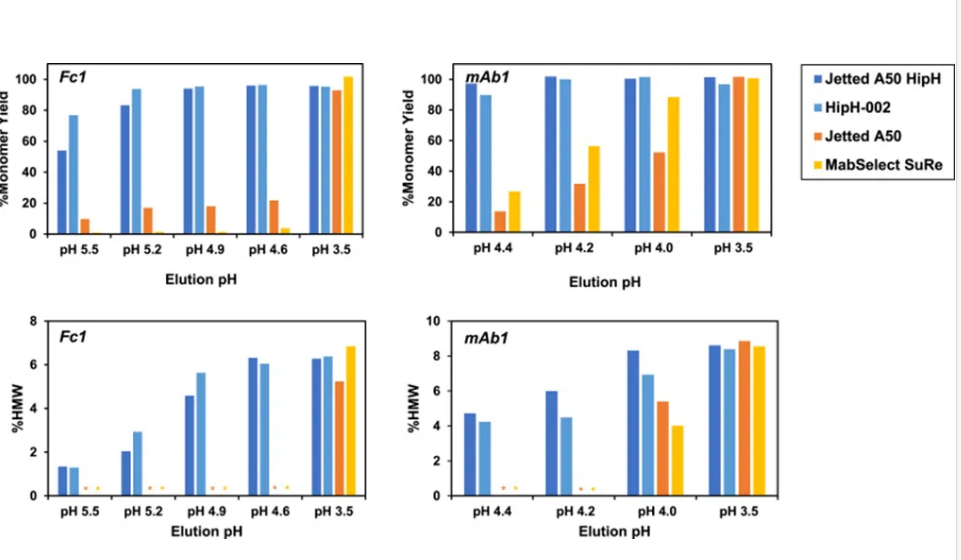
图 4. 使用Fc1 和 mAb1 在Protein A 填料上进行等度洗脱实验时单体收率和洗脱液 HMW 水平。Fc1 测试了 5 个洗脱 pH,最高 pH 为 5.5;mAb1 测试了 4 个洗脱 pH,最高 pH 为 4.4。上样中的起始 HMW水平为 Fc1 的 7.1% 和 mAb1 的 8.7%。由于产物回收率低,没有对所有 Jetted A50 和 MabSelect SuRe 洗脱液进行 HMW 测量。
图4左侧的图表汇总了Fc1的等度洗脱实验结果,洗脱缓冲液的pH值分别为5.5、5.2、4.9、4.6和3.5。对于HipH-002填料,在洗脱pH值为5.2或更低时,单体收率超过88%。在pH值5.5和5.2时,HipH-002的收率高于Jetted A50 HipH。这一观察结果与脉冲注射和梯度洗脱数据相一致,其中HipH-002的洗脱峰最大pH值高于Jetted A50 HipH。正如预期,Jetted A50和MabSelect SuRe仅在洗脱pH值为3.5时才能实现高收率。需要低pH值才能将分子从传统的Protein A填料上洗脱,但这也会导致结合在柱上的HMW杂质一同洗脱,使得HMW杂质的去除率极低。相比之下,在Jetted A50 HipH和HipH-002上使用pH 5.2进行洗脱,可获得高Fc1收率,且洗脱液中的HMW杂质水平分别从上样中的7.1%降低至2.0%和2.9%。这表明HipH填料具有额外的优势,即通过扩大洗脱pH范围来改善聚体的去除。
图4右侧的图表汇总了使用pH值为4.4、4.2、4.0和3.5的洗脱缓冲液对mAb1进行等度洗脱实验的结果。当洗脱pH值为4.4或更低时,HipH填料的单体收率超过90%。在pH 4.4时,Jetted A50 HipH的收率略高于HipH-002,这与脉冲注射数据一致,其中Jetted A50 HipH的洗脱峰最大pH略高于HipH-002。与Fc1类似,使用Jetted A50和MabSelect SuRe纯化mAb1时,仅在采用pH为3.5的洗脱缓冲液时才能获得高收率,但此时HMW杂质的去除率极低。相比之下,当在Jetted A50 HipH和HipH-002上以pH 4.4进行洗脱时,洗脱液中的HMW杂质水平分别从上样中的8.7%降低至4.7%和4.2%。
在后续讨论的实验中,针对每种分子选择具有最温和洗脱pH值的HipH填料,用于洗涤缓冲液的筛选,并利用澄清的细胞培养收获物来评估工艺性能和产物质量。具体而言,对于Fc1的纯化,进一步在HipH-002上进行评估;而对于mAb1的纯化,则进一步在Jetted A50 HipH上进行评估。
洗涤条件评估
Protein A层析对含Fc蛋白具有高选择性和亲和力,有望高效清除工艺相关杂质,如宿主细胞蛋白(HCP)。可以通过使用不同的添加物或调节pH值的中间洗涤步骤来增强对松散结合的HCP甚至难以去除的HCP的清除效果。这被证明是减轻后续精纯步骤负担的关键有效方法。因此,本文评估了表5和表6中列出的Protein A层析常用洗涤缓冲液在HipH填料上清除HCP的效果及其对产量的影响。此次评估的目的是确定,在HipH填料的结合亲和力发生变化的情况下,使用传统洗涤缓冲液是否仍能有效清除HCP并实现高回收率。
表5.不同洗涤缓冲液对Fc1的收率和宿主细胞蛋白清除率的影响。
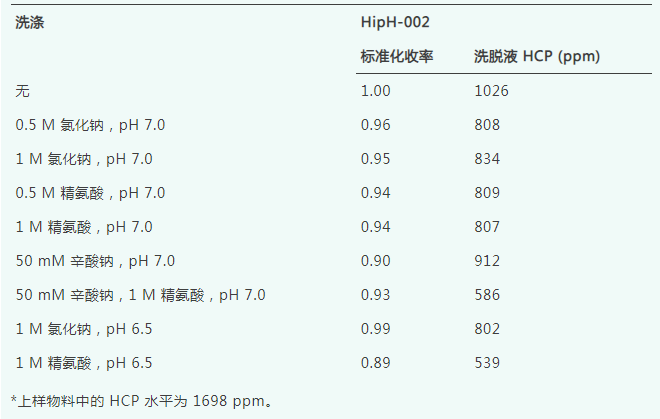
表6.不同洗涤缓冲液对mAb1收率和宿主细胞蛋白清除率的影响
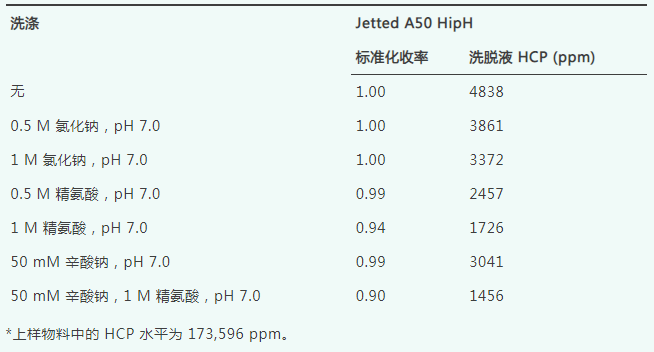
在HipH-002上对Fc1进行洗涤评估实验,使用表5所示的8种不同洗涤剂各三个柱体积,并采用pH为5.2的洗脱缓冲液。每次运行的收率均标准化为无洗涤对照运行的收率,以确定洗涤步骤导致的具体收率损失。50 mM辛酸钠与1 M精氨酸(pH 7.0)的组合以及1 M精氨酸(pH 6.5)的组合可实现最高的HCP清除率。这一结果与之前在传统Protein A填料上清除Fc1的HCP的经验相符。为了在收率和HCP清除率之间取得平衡,50 mM辛酸钠和1 M精氨酸(pH 7.0)被确定为Fc1 HCP清除的最佳洗涤剂组合。同样,在Jetted A50 HipH上对Fc1进行了洗涤缓冲液筛选,使用相同的洗脱缓冲液pH 5.2和表5所示的洗涤缓冲液,显示出与HipH-002相似的收率和HCP去除趋势。然而,与HipH-002上的运行相比,Jetted A50 HipH上所有运行的收率略低(数据未展示),这与等度洗脱评估的预期一致。
此外,当采用1 M pH 6.0的精氨酸作为洗涤缓冲液时,洗涤过程中的收率损失达到65%。这一结果表明,高浓度的精氨酸和较低的pH值在削弱蛋白质与配基之间的相互作用方面发挥了重要作用。这也意味着,若需采用更温和的pH值,可在温和洗脱pH填料上添加精氨酸等改性剂,以进一步提升洗脱pH值。
对于mAb1,在Jetted A50 HipH上使用表6中所示的6种洗涤缓冲液各三倍柱体积,并采用pH为4.4的洗脱缓冲液进行洗涤评估实验。初步研究表明,使用pH为6.5的洗涤缓冲液会导致显著的收率损失,因此这些缓冲液未被包含在mAb1的洗涤评估中。含有1 M精氨酸和50 mM辛酸钠的洗涤条件与无洗涤运行相比导致收率损失,并展示了HCP去除与回收率之间的权衡。为了在收率和HCP清除率之间取得平衡,确定pH为7.0的0.5 M精氨酸是mAb1 HCP清除的最佳洗涤剂。同样,在HipH-002上对mAb1进行了洗涤缓冲液筛选,使用相同的pH为4.4的洗脱缓冲液和表6中所示的洗涤缓冲液,显示出与Jetted A50 HipH相似的收率和HCP去除趋势。然而,与Jetted A50 HipH上的运行相比,HipH-002上所有运行的收率都略低,这与等度洗脱评估的预期一致。
总体而言,这些结果表明,在传统Protein A填料上用于清除宿主细胞蛋白(HCP)的常用洗涤缓冲液也能成功地去除温和洗脱pH填料上的HCP。由于与HCP的相互作用具有分子特异性,因此需要针对每种目标蛋白确定最佳的洗涤缓冲液。pH低于7.0的洗涤缓冲液可能有助于提高HCP去除率,但通常会以降低收率或上样密度为代价,因为在这些洗涤条件下,蛋白质可能会被部分洗脱。
在优化条件下纯化澄清的细胞培养物
对澄清的细胞培养收获物进行纯化,以评估与传统填料相比,温和洗脱pH Protein A层析填料在最佳条件下对Fc1和mAb1的选择性纯化能力。Fc1在HipH-002上进行纯化,洗脱pH设定为5.2;mAb1则在Jetted A50 HipH上进行纯化,洗脱pH设定为4.4。将这些经过优化的温和洗脱运行结果与在Jetted A50和MabSelect SuRe上、洗脱pH为3.5的纯化运行结果进行比较。所有Fc1的运行过程中均加入了50 mM辛酸钠和1 M精氨酸(pH 7.0)的中间HCP洗涤液;所有mAb1的运行过程中均加入了0.5 M精氨酸(pH 7.0)。
表7总结了在最佳温和洗脱pH填料上纯化后洗脱液的工艺性能和产物质量,并将其与两种传统Protein A填料进行了比较。对于Fc1,HipH-002上的收率与两种传统Protein A填料相当,后者的洗脱液中HMW水平较低。这是因为HipH-002上的洗脱pH更高,且柱上HMW物质与单体的分离效果更好。使用pH 5.2的洗脱缓冲液时,洗脱pH低于梯度实验中UV峰最大值出现的pH(pH 5.7),从而实现了蛋白质的高回收率。pH 5.2也高于发生50% HMW去除的pH(pH 5.0),这表明在该洗脱pH下,大部分HMW仍然与柱结合,从而在Protein A步骤中更有效地去除了HMW。此外,与传统Protein A填料相比,HipH-002的HCP清除率相当。
表7. 细胞培养收获物纯化的工艺性能和洗脱产物质量。
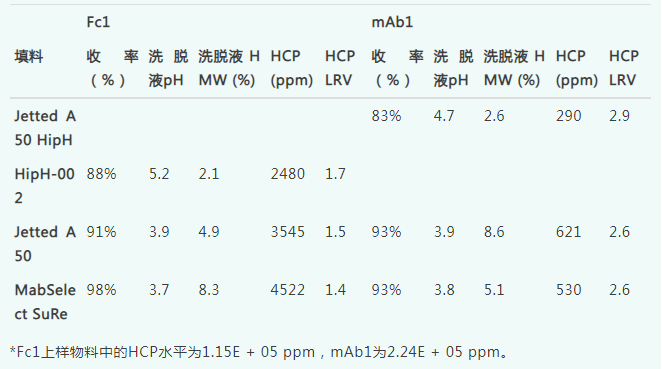
对于mAb1,在Jetted A50 HipH上的收率相较于传统Protein A填料大约低了10%。在此次使用细胞培养材料作为上样的运行中,观察到洗涤步骤中存在收率损失,推测这可能是由于分子与配基之间的结合强度减弱所致。而当使用Protein A洗脱液作为上样材料时,在相同的洗涤和洗脱条件下,洗涤步骤中的收率损失最小。这表明,使用细胞培养材料而非纯化蛋白作为上样的等度洗脱和洗涤评估实验,可能会对收率方面的最佳洗涤和洗脱缓冲液选择得出不同的结论。此外,由于洗脱pH缓冲液较为温和,Jetted A50 HipH上的洗脱液峰出现拖尾现象,导致峰收集不完整,从而使得收率较低。采用pH稍低的洗脱缓冲液或增加洗脱体积可以提高回收率。相比之下,Jetted A50或MabSelect SuRe在中间洗涤中没有损失,其洗脱峰非常尖锐。与Fc1类似,Jetted A50 HipH的洗脱pH值较高(4.4),有助于提高HMW清除率,使得结合力更强的HMW物质留在柱上。Jetted A50 HipH上的HCP清除率也与传统Protein A填料相当。
表7仅展示了使用最温和洗脱pH的最佳HipH填料的结果,以凸显其优势。此外,还使用与最佳HipH填料相同的洗脱和洗涤缓冲液,在Jetted A50上对Fc1进行细胞培养纯化,在HipH-002上对mAb1进行细胞培养纯化,结果表明HipH填料能够在比传统Protein A填料更温和的pH条件下实现洗脱,同时有效去除HMW和HCP杂质。然而,与HipH-002相比,Jetted A50 HipH上使用Fc1的收率略低;与Jetted A50相比,在HipH-002上使用mAb1的产量略低,这与等度洗脱评估的预期一致。因此,需要针对每种目标蛋白质和每种填料确定最佳的缓冲液和运行条件,以在收率、杂质去除和洗脱液pH(如有必要)之间取得最佳平衡。
Protein A层析通常不用于去除高分子量(HMW)杂质,因为疏水相互作用层析(HIC)和阳离子交换层析(CEX)等模式在这方面更为有效。然而,在工艺早期去除杂质有助于减轻后续精纯步骤的负担,从而实现更高的上样量和提高收率。尽管已有研究证明Protein A层析能够分离HMW和单体,但所需条件往往导致收率不理想或需要添加盐。由于回收率低或与后续步骤的工艺连接困难,这两种选择对于大规模生产来说都是不理想或不可行的。使用标准Protein A方案,HipH填料能够显著降低HMW含量并获得可接受的收率,只需改变洗脱pH值即可。
洗脱pH对pH敏感分子的影响
在上一节中讨论的HipH-002、Jetted A50和MabSelect SuRe细胞培养运行中,天然Fc1洗脱物的稳定性在48小时内进行了评估。HipH-002使用pH 5.2的洗脱缓冲液进行洗脱,而Jetted A50和MabSelect SuRe则使用pH 3.5的洗脱缓冲液进行洗脱。
表7展示了洗脱完成后10分钟内测定的Fc1天然洗脱液的pH值和洗脱液中的HMW水平。从图5可以看出,与HipH-002相比,Jetted A50和MabSelect SuRe的天然洗脱液起始HMW水平更高。这可能是由于在柱上发生或快速聚集和HMW分离的结合所致。已知Fc1在pH低于4.5时不稳定。因此,在Jetted A50和MabSelect SuRe上使用低pH洗脱可能会导致在柱洗脱时以及收集的洗脱液中发生聚集,因为天然洗脱液的pH值分别为3.7和3.9。此外,由于HMW与柱的结合更强,与传统Protein A填料(将HMW与产物一起洗脱)所需的低pH值洗脱相比,HipH-002上较温和的pH值洗脱可以选择性地洗脱产物,而保持HMW结合。传统的Protein A洗脱液在低pH下48小时内不稳定,Jetted A50洗脱液的HMW从4.9%增加到9.1%,MabSelect SuRe洗脱液的HMW从8.3%增加到16.4%。相比之下,天然HipH-002洗脱液的pH高于4.5,HMW水平在48小时内保持稳定。由于HipH填料可以用较温和的洗脱pH洗脱,因此Protein A洗脱液的纯度和稳定性都有所提高。
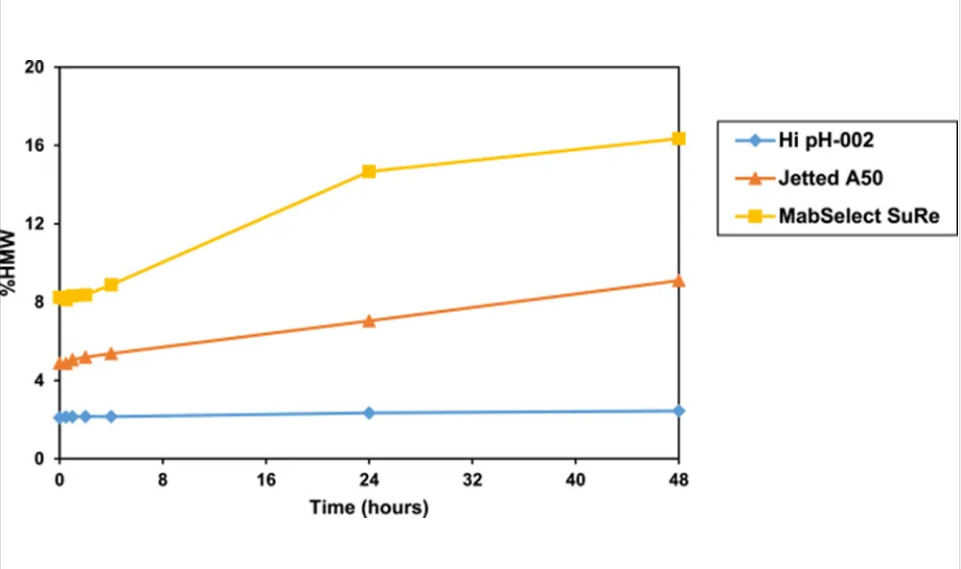
图 5.天然 Fc1 Protein A 洗脱物的稳定性。使用 HipH-002、Jetted A50 和 MabSelect SuRe 在优化条件下从澄清细胞培养液中纯化后 48 小时内天然 Fc1 Protein A 洗脱物的 HMW 水平比较。
Jetted A50 HipH 实施注意事项
为了加速工艺开发进程,公司通常采用适用于大多数产物的平台工艺。借助易于理解和模板化的工艺,可以大幅减少时间和资源投入,其中每个分子仅需优化少数参数。Protein A层析通常是平台工艺中的首个层析步骤,因为它能够选择性地捕获和浓缩细胞培养物中的产物。然而,对于那些在低pH下容易聚集的复杂蛋白质(如某些非典型单克隆抗体),它们可能无法很好地适应标准的平台工艺,从而迫使工艺偏离既定流程,并显著增加工艺开发时间。Jetted A50 HipH作为平台Protein A填料的主要候选者,其优势在于能够适用于任何含Fc的蛋白质,无论其对低pH的敏感性如何,并且只需对上样、洗脱和洗脱阶段的缓冲液及体积进行优化。温和的洗脱pH运行条件带来了更宽广的操作范围,但与传统Protein A填料通常呈现的尖锐且浓缩的洗脱液峰相比,可能会出现洗脱峰拖尾和洗脱液收集量增加的情况。在确定最优操作条件时,需要权衡收率、HMW清除率、天然洗脱液pH和洗脱体积等因素,以实现最佳性能和收率的平衡。相较于使用传统Protein A填料,这可能会略微增加该Protein A步骤的开发时间,但从纯度角度来看是有益的。Jetted A50 HipH可以轻松替代平台工艺中现有的Protein A填料,并与现有的下游工艺无缝集成。
Protein A填料(包括Jetted A50 HipH)面临的主要挑战之一是其寿命和可清洁性,而填料的高成本使得这一问题更加突出。收率和结合载量的下降通常归因于在清洁过程中填料暴露于碱性条件下导致的配基水解,以及杂质的积累导致填料污染。本研究未对填料循环进行评估。供应商声称,Jetted A50 HipH在暴露于0.1 M氢氧化钠120小时后仍能保持出色的载量(>85%初始动态结合载量,DBC)。这与MabSelect SuRe LX相比要低得多,后者在配基水解研究中,填料在暴露于0.1 M氢氧化钠约250小时后仍能保持容量(>85%初始DBC)。填料寿命与成本直接相关,因为填料的成本可以在各个循环中分摊,填料寿命越短,每个循环的填料成本就越高。在填料寿命研究中,必须同时评估填料污染和配基水解,以评估在代表性工艺条件下的填料循环,因为杂质可以非特异性地与填料结合,阻碍与配基的接触。与仅评估配基水解的研究相比,同时评估污染和配基水解的填料寿命研究观察到载量和收率下降得更快、更严重,这表明与配基水解相比,填料污染在降低结合载量方面起着更重要的作用。然而,填料污染和配基水解的速率取决于细胞培养基、碱再生溶液和每个循环的接触时间。因此,需要对每个分子和填料进行完整的柱循环研究,以确定在代表性工艺条件下的填料寿命。
结论
与传统的Protein A填料Jetted A50和MabSelect SuRe相比,两种温和洗脱pH的Protein A填料Jetted A50 HipH和原型HipH-002成功地在较温和的pH条件下洗脱了6种分子。新商业化的Jetted A50 HipH填料展现出更广泛的温和洗脱特性,大多数评估的蛋白质的洗脱pH达到4.6或更高,预计能够在比传统Protein A填料更温和的pH下成功洗脱所有含Fc的蛋白质。HipH填料不仅具有与传统Protein A填料相当的高结合载量和回收率,还表现出使用典型清洗去除杂质的能力,从而可以无缝集成到传统的Protein A纯化平台工艺中。对于那些在低pH下不稳定而无法使用传统Protein A层析的蛋白质,这项技术将带来极大的益处,因为蛋白质可以在温和的pH下洗脱,避免暴露于低pH条件。在温和pH下洗脱的能力将避免在洗脱缓冲液中使用改性剂或直接中和,从而实现更好的工艺连接和设备适配,并且所需的生产控制不那么严格。对于所有蛋白质,即使在低pH下稳定,HipH填料也能提供更宽的操作窗口,这可以显著改善HMW杂质的去除,减轻后续精纯步骤的杂质负担。对于那些希望使用熟悉的Protein A工艺,并且能够灵活地兼容所有含Fc蛋白质(无论是不稳定的还是稳定的)的填料的人来说,Jetted A50 HipH是平台Protein A层析填料的理想选择。
参考资料:
F.A.S.Wang, Y.Fan, W.K.Chung, et al., Evaluation of mild pH elution protein A resins for antibodies and Fc-fusion proteins. Journal of Chromatography A, 2024.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57