高侵袭性肿瘤已经进化到可以抑制 cGAS-STING 通路来进行免疫逃逸,但这种劫持的机制尚不清楚。
2025 年 3 月 3 日,浙江大学许大千团队在 Nature 子刊 Nature Cell Biology 上发表了题为:ADSL-generated fumarate binds and inhibits STING to promote tumour immune evasion 的研究论文。
该研究阐明了腺苷酸琥珀酸裂解酶(ADSL)的代谢产物富马酸结合并抑制 STING 从而促进肿瘤免疫逃逸的新机制,从而提出了靶向 ADSL 的非经典功能介导的 STING 抑制来增强免疫检查点治疗疗效的新策略。

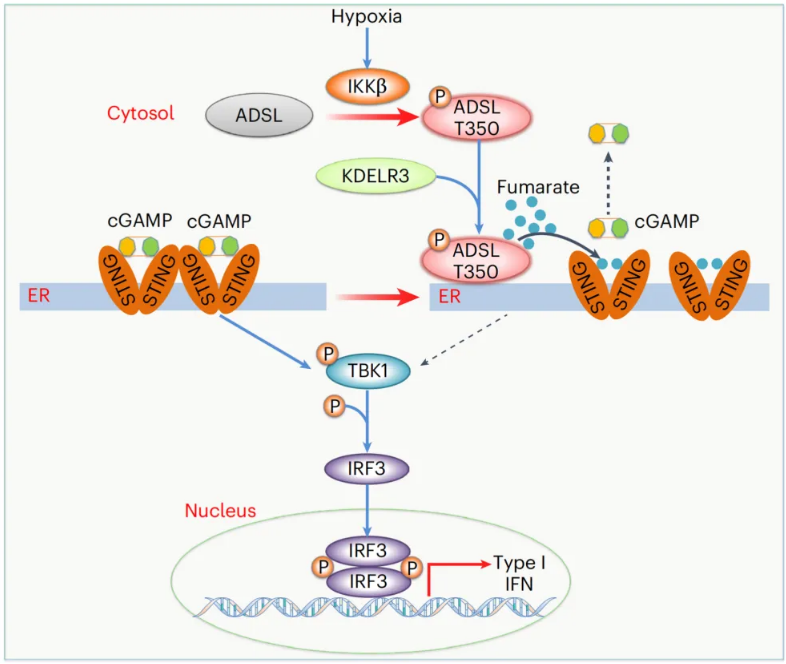
在这项最新研究中,研究团队证实,缺氧条件可显著激活正常乳腺上皮细胞的 STING 信号通路,但在乳腺癌细胞中未观察到类似激活效应。从机制上来说,腺苷酸琥珀酸裂解酶(ADSL)是嘌呤从头合成的关键代谢酶,在乳腺癌组织中高表达,并在第 350 位苏氨酸位点(T350)位点被缺氧激活的 IKKβ 磷酸化。磷酸化的 ADSL 与 STING 在内质网相互作用,ADSL 的代谢产物富马酸与 STING 结合,抑制 cGAMP 与 STING 的结合、STING 的激活以及随后的 IRF3 依赖的细胞因子基因表达。干扰 ADSL-STING 的关联可促进 STING 激活并抑制肿瘤生长。
值得注意的是,ADSL 内质网转位阻断肽和抗 PD-1 抗体的联合治疗,诱导了对肿瘤生长的叠加抑制作用,同时显著增加了免疫应答。
此外,该研究还发现 ADSL 在 T350 位点的磷酸化水平与乳腺癌患者的 STING 激活水平呈负相关,并预示着不良预后。
总的来说,这项研究强调了肿瘤细胞中腺苷酸琥珀酸裂解酶(ADSL)的代谢产物富马酸在抑制 STING 激活中的关键作用,发现了有望重塑肿瘤免疫微环境的代谢新靶标,并揭示了通过靶向 ADSL 的非经典功能介导的 STING 抑制来改善免疫检查点治疗的新策略。
论文链接:
https://www.nature.com/articles/s41556-025-01627-8



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57