为了应对食物匮乏或恶劣的环境条件,许多哺乳动物会采取节能策略,例如蛰伏(Torpor)和冬眠(Hibernation)。蛰伏是一种代谢率显著降低的状态,会导致核心体温(Tb)下降,这种状态可持续数小时至数天,而冬眠是一种季节性行为,由多次蛰伏期组成,期间会周期性地苏醒至正常体温。因此,蛰伏是一种短时间、灵活的“节能模式”,冬眠是长期性、深度休眠的“生存策略”。
之前的研究发现,蛰伏和冬眠与延长寿命有关。然而,目前还不清楚蛰伏影响衰老的潜在机制,以及是否可以通过诱导低温和低代谢状态来减缓衰老和延长健康寿命。
2025年3月7日,麻省理工学院(MIT)的研究人员在 Nature 子刊 Nature Aging 上发表了题为:A torpor-like state in mice slows blood epigenetic aging and prolongs healthspan 的研究论文。
该研究表明,诱导蛰伏样状态(torpor-like state,TLS)能够减缓小鼠血液表观遗传衰老并延长其健康寿命。该研究揭示了体温在衰老调控中的独立且核心的作用,为抗衰老研究提供了新靶点,并展示了化学遗传学模型在解析复杂生理过程中的强大能力。

在这项研究中,研究团队通过化学遗传学激活小鼠下丘脑视前区(POA)的前腹侧的内侧和外侧视前区(avMLPA),成功诱导出蛰伏样状态(torpor-like state,TLS)。TLS表现为核心体温下降(平均降低7°C)、代谢率降低 56%、食物摄入减少 81%,并伴随活动度下降。
通过反复周期性 TLS 来模拟自然冬眠模式,结果显示,长期 TLS 使小鼠的血液表观衰老速度减缓 76%,且效应具有累积性和持续性,这种衰老减缓效果在停止 TLS 后仍持续 3 个月。此外,这种表观衰老减缓具有组织特异性,例如,肝脏的表观年龄减缓 20%,而肾脏和大脑皮层无显著变化。该研究还发现,TLS 小鼠的虚弱指数显著低于对照组,提示了生理功能衰退的减缓,健康寿命得到改善。
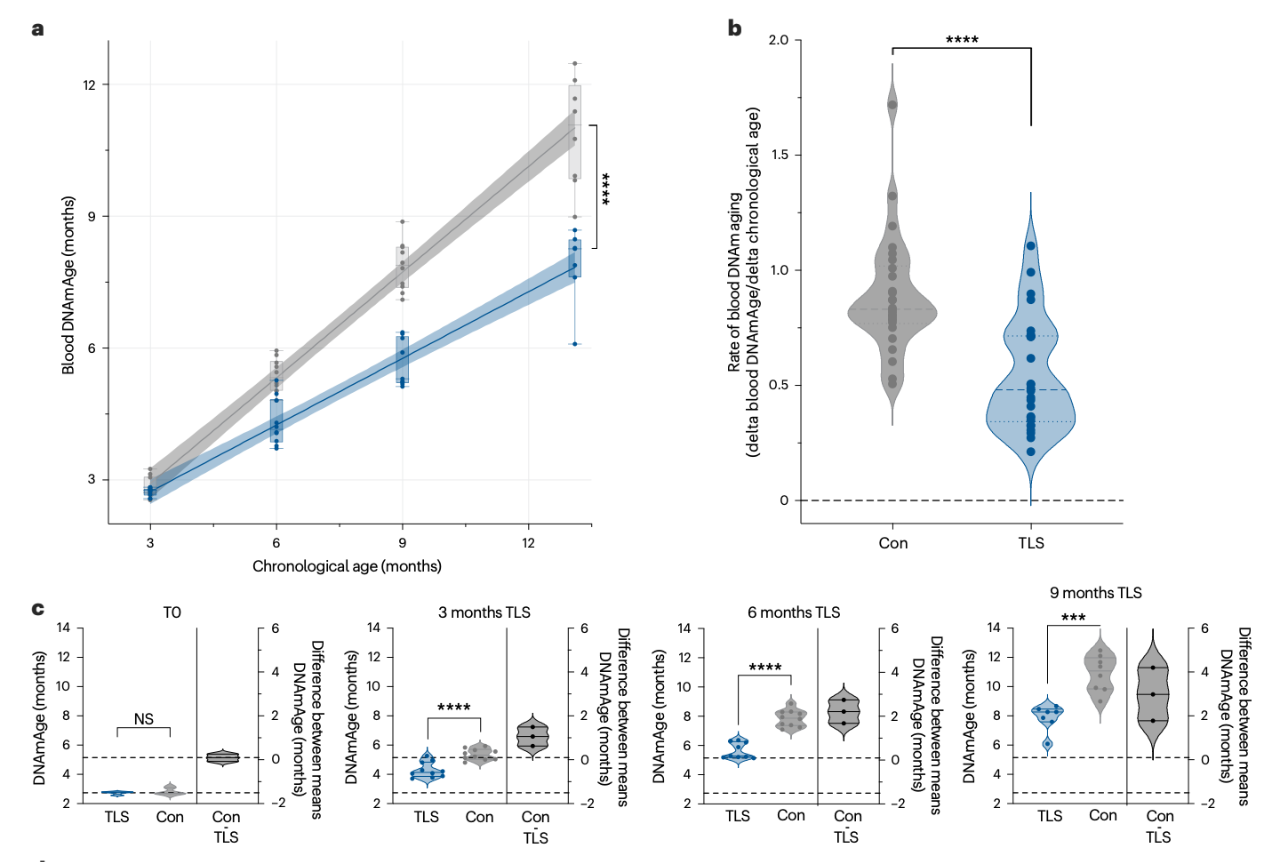
从机制上来说,体温降低是衰老减缓和健康寿命延长的核心因素,通过控制环境温度排除代谢率变化的影响,研究团队发现,仅体温降低就足以减缓血液表观衰老,而模拟 TLS 的代谢率下降和食物摄入下降,但没有体温下降,则无法复制出 TLS 的抗衰老效应。
总的来说,这项研究支持了“体温是衰老关键调节因子”的假说,挑战了传统的“代谢率决定寿命”理论,揭示了体温在衰老和寿命中的核心作用,为开发基于体温调控的抗衰老干预(例如药物或神经调控技术)提供了科学依据。
论文链接:
https://www.nature.com/articles/s43587-025-00830-4



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57