3月18日,国家药监局官网挂出了CDE的《2024年度药品审评报告》,该报告对2024年药品申请、注册、审评审批等做了详实的信息披露,并回顾了2024年药品审批主要工作。

药品注册申请申报量方面
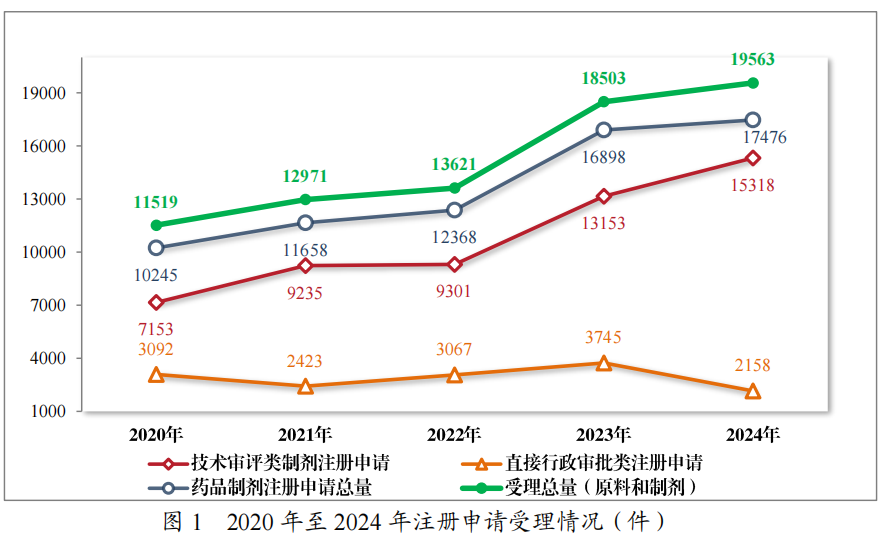
2024 年,药品注册申请申报量持续增长,药审中心受理各类注册申请 19563 件(同比增加 5.73%,以受理号计,下同),包括药品制剂注册申请 17476 件(同比增加 3.42%),化学原料药注册申请 2087 件(同比增加 30.03%)。17476 件药品制剂注册申请包括技术审评类注册申请 15318 件(同比增加 16.46%),直接行政审批类注册申请 2158件(包括补充申请和一次性进口)。2020 年至2024 年注册申请受理情况详见图1。
药品注册申请审评审批方面
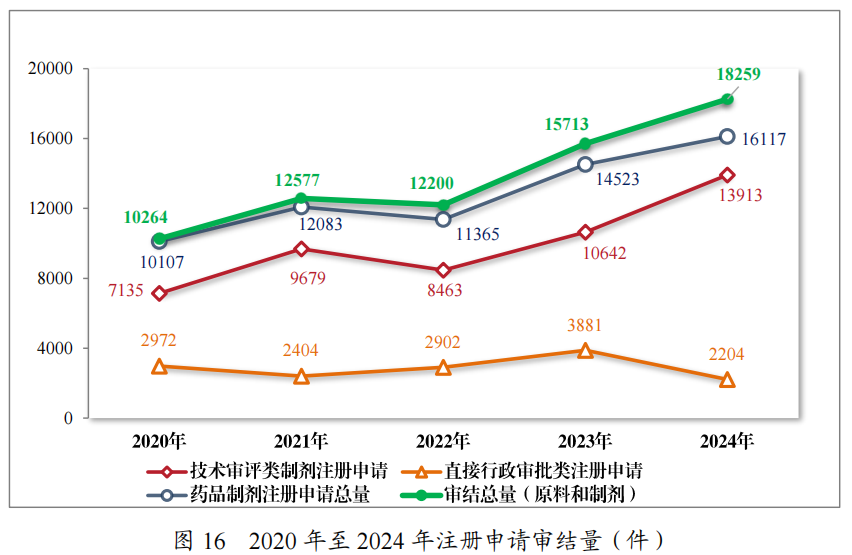
2024 年,药审中心审结各类药品注册申请共 18259 件(同比增加 16.20%),包括药品制剂注册申请 16117 件(同比增加10.98%),化学原料药注册申请 2142 件(同比增加80.00%)。16117 件药品制剂注册申请包含技术审评类注册申请 13913 件(同比增加 30.74%),直接行政审批类注册申请 2204 件。2020 年至 2024 年药品注册申请审结量详见图 16。
2024 年,药审中心以临床价值为导向,采取多种措施提高审评效率,加快新药好药上市,为患者提供更多的用药选择。
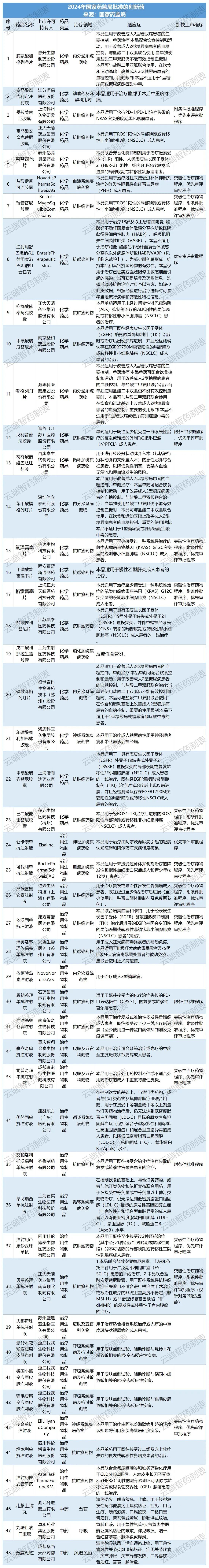
全年批准上市 1 类创新药 48 个品种1(详见附件 1),其中 17 个品种(35.4%)通过优先审评审批程序批准上市,11 个品种(22.9%)附条件批准上市,13 个品种(27.1%)在临床试验期间纳入了突破性治疗药物程序。
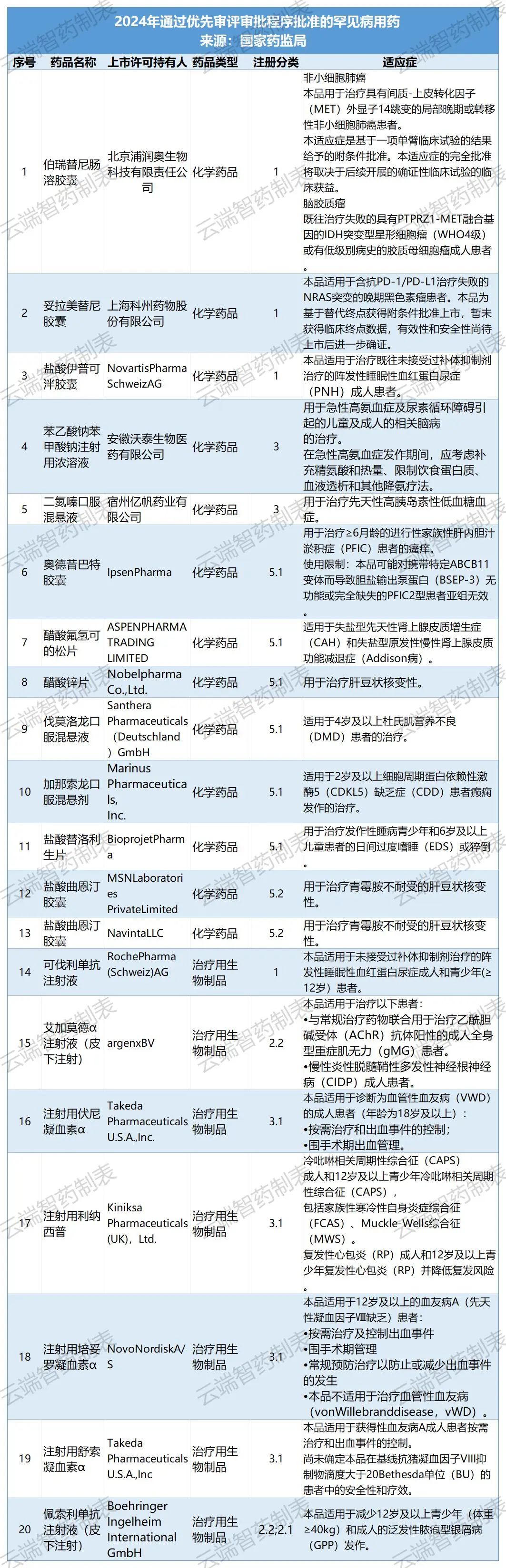
全年批准罕见病用药55 个品种(未包括化学药品 4 类仿制药),其中 20 个品种(36.4%)通过优先审评审批程序加快上市(详见附件2),2 个品种附条件批准上市。
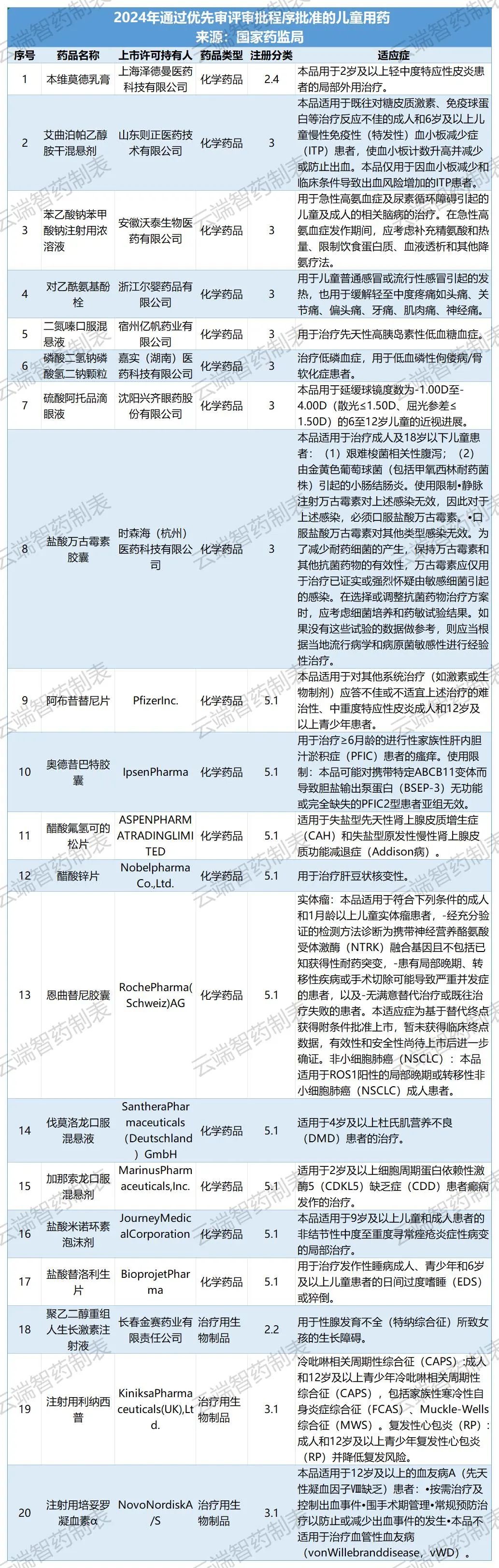
全年批准儿童用药 106 个品种,包含 71 个上市许可申请,其中20 个品种(18.9%)通过优先审评审批程序加快上市(详见附件 3);另批准 35 个品种扩展儿童适应症。
全年批准境外已上市境内未上市的药品(化学药品 5.1 类、治疗用生物制品 3.1 类和预防用生物制品 3.1 类)89 个品种,其中 64 个为首次批准上市,25 个为已上市药品增加适应症,详见附件 4。(略)



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57