近日,再鼎医药在clinical trials网站上,登记了一项DLL-3 ADC药物ZL-1310,在大细胞神经内分泌癌(LCNEC)、神经内分泌前列腺癌(NEPC)和胃肠胰腺神经内分泌癌(GEP-NEC)等多种实体瘤患者中,启动一项Ib/II期临床试验NCT06885281,该临床预计于2025年4月启动,入组人数为86例。

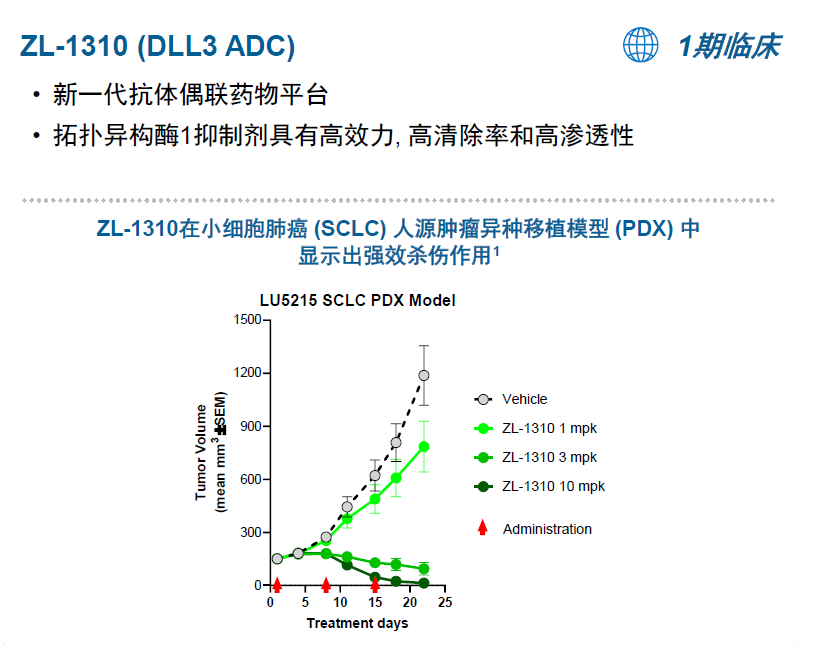
ZL-1310为一款靶向DLL3的ADC新药,采用新一代ADC技术构建,TOPO1抑制剂作为payload具有高效力、高清除率和高渗透性的作用特点。ZL-1310在临床前研究的小细胞肺癌PDX模型中显示出强效杀伤作用。
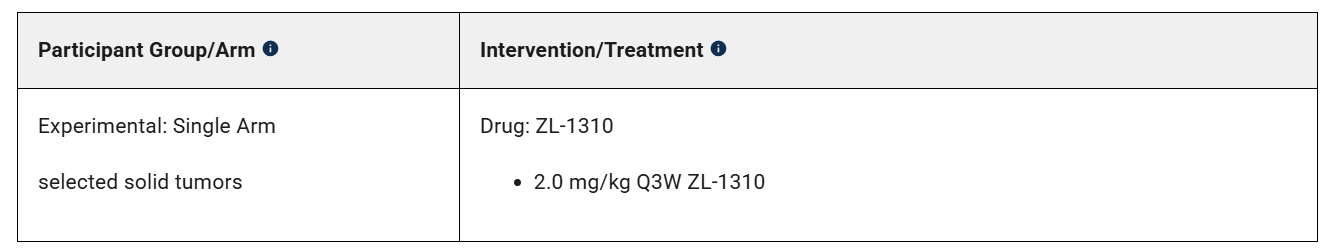
值得注意的是,再鼎直接将ZL-1310的剂量确定为2 mg/kg,也就是基本确定RP2D。
此前,再鼎医药在2024 年 EORTC-NCI-AACR(ENA)大会上,以口头报告的形式,公布了ADC 新药 ZL-1310 全球 Ia 期临床研究数据,至少接受过一次治疗后评估的患者 ORR 为 74%。
该会议上布了正在进行的 Ia 部分单药治疗剂量递增研究的数据,其中包括四个剂量组(0.8 mg/kg、1.6 mg/kg、2.0 mg/kg 和 2.4 mg/kg)中 25 位患者的研究结果。其中 19 例可评估患者中,至少接受过一次治疗后评估的患者 ORR 为 74%(95%CI, 48.8, 90.9)。
DLL3 H-Score 评分大于 5(范围:5-260)的患者均表现出肿瘤缓解。在 19 位患者中出现应答的 14 位患者中,有 13 位仍基线有脑转移且可评估疗效的六位患者,均获得部分缓解(PR)。
ZL-1310 在所有剂量水平下均具有良好的耐受性,大多数治疗出现的不良事件(TEAE)为 1 级或 2 级。在 2.4 mg/kg 剂量组观察到 DLT 。25 位患者中有 5 位(20%)发生了≥3 级以上的治疗相关不良事件;2 位患者(8%)发生了严重的治疗相关不良事件;3 位患者(12%)需要降低剂量,没有患者因 TEAE 而终止治疗。
19 位患者中,所有患者均在接受标准含铂化疗后出现进展,92% 的患者在接受免疫检查点抑制剂治疗后出现进展。56% 的患者此前至少接受过两种治疗但均失败。28% 的患者在基线时存在脑转移。
参考来源:
UmabsDB、医药笔记、Insight数据库.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57