3月24日~3月30日期间,共75个品种通过/视同通过一致性评价。同期,70个品种申报一致性评价。
华邦制药卡泊三醇倍他米松软膏
近日,国家药品监督管理局正式批准了重庆华邦制药研发的卡泊三醇倍他米松软膏上市,成为国内首个通过仿制药一致性评价的同类产品。该药品的上市标志着我国在银屑病治疗领域实现重要突破,结束了利奥制药原研产品的市场独占格局。
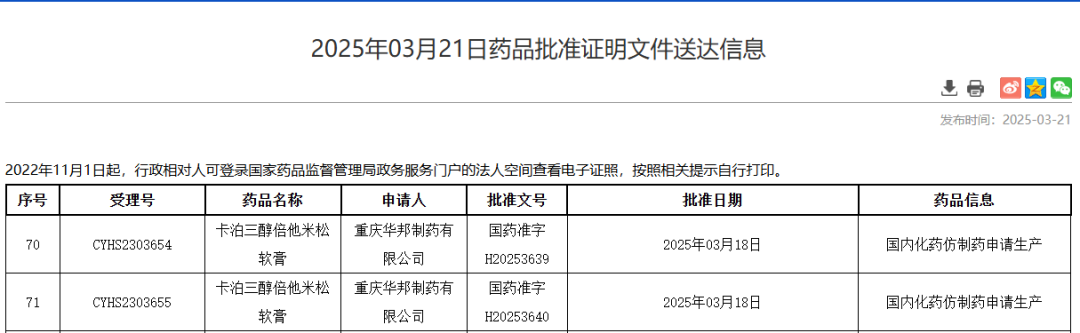
图片来源:NMPA
官网银屑病(俗称牛皮癣)是一种慢性、全身性、炎症性皮肤疾病,全球患者约1.25亿人,我国患者超过650万。其典型症状为皮肤红色斑块覆盖银白色鳞屑,常伴随关节炎、糖尿病、高血压等共病,且存在难根治、易复发的特点。
银屑病作为慢性非传染性疾病,其共病被世卫组织列为重大健康威胁,患者对外用治疗存在迫切需求。卡泊三醇的研发始于1985年日本医生使用维生素D3治疗骨质疏松时的意外发现。
由于口服会导致血钙升高,丹麦利奥制药将其改良为外用制剂,并于1991年推出全球首个卡泊三醇软膏「达力士」,该产品1994年进入中国并持续服务患者至今。
此后,利奥制药进一步推出卡泊三醇与倍他米松的复方制剂「得肤宝」,通过协同作用提升疗效并降低副作用,成为国际银屑病治疗金标准。
此次华邦制药的国产首仿,将改写我国复方制剂完全依赖进口的局面。卡泊三醇倍他米松软膏由两种活性成分组成:卡泊三醇(维生素D类似物):精准调控皮肤细胞增殖分化,改善斑块增厚;二丙酸倍他米松(糖皮质激素):快速抑制炎症反应,缓解红斑及瘙痒;临床数据显示,该复方较单药治疗有效率提升30%,且将皮肤萎缩等不良反应发生率控制在2%以下。其疗效在2021年中国医科大学牵头的多中心试验中获验证,斑块清除率与原研药无统计学差异。根据药智数据显示,2024 年卡泊三醇倍他米松软膏原研药「得肤宝」销售额达到了 1.68 亿元,华邦的产品上市后,将打破利奥的国内市场垄断,银屑病治疗市场格局发生改变。除此之外,四川海思科和江苏知原药业也在开发同类产品,但两家企业的目前仍处于临床试验阶段,尚未进入生产申报环节。
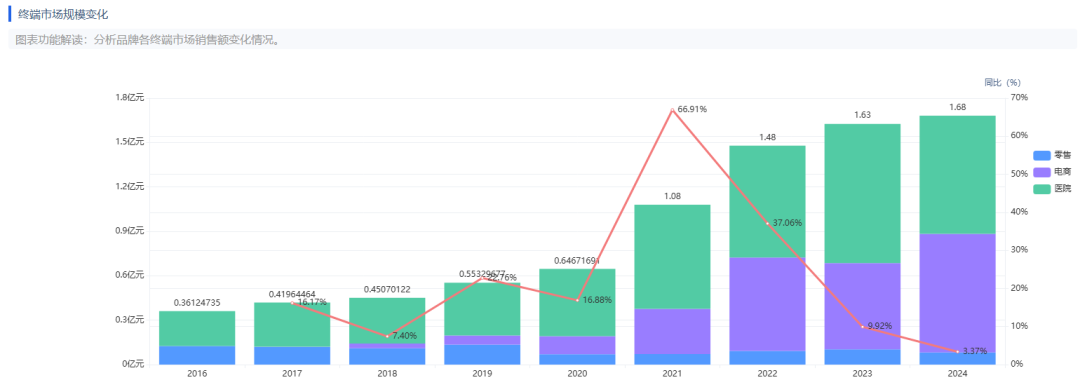
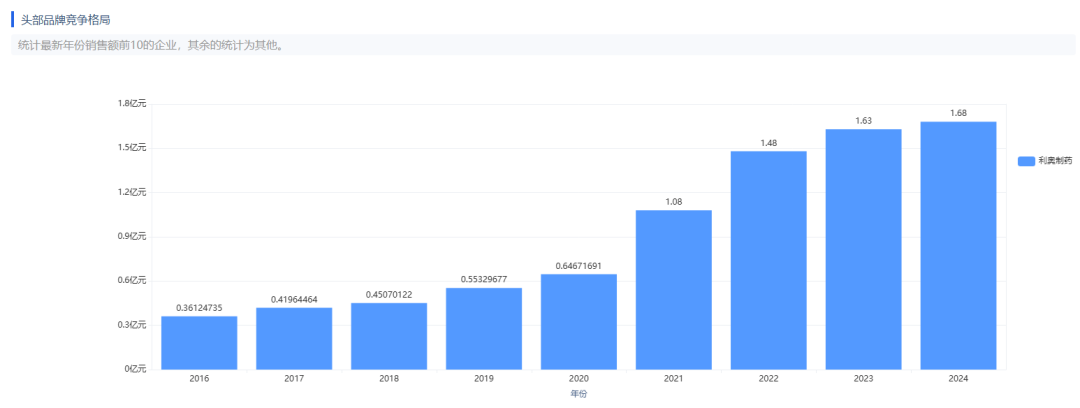
图片来源:药智数据——药品市场全终端分析系统

图片来源:药智数据——药品注册与受理数据库
尽管面临原研药企的竞争压力,华邦制药的首仿产品仍为我国银屑病治疗提供了重要补充。其市场表现将检验国产复杂制剂的技术实力,也为后续类似品种的开发提供了宝贵经验。
一致性评价通过情况3月24日~3月30日期间,共75个品种通过/视同通过一致性评价。具体情况如下:
表1:3月24日~3月30日 ,通过一致性评价的品种
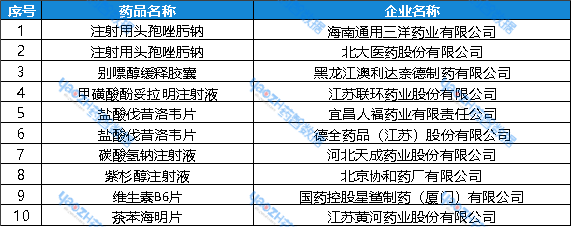
数据来源:药智数据——仿制药一致性评价分析系统
表2:3月24日~3月30日,视同通过一致性评价的品种
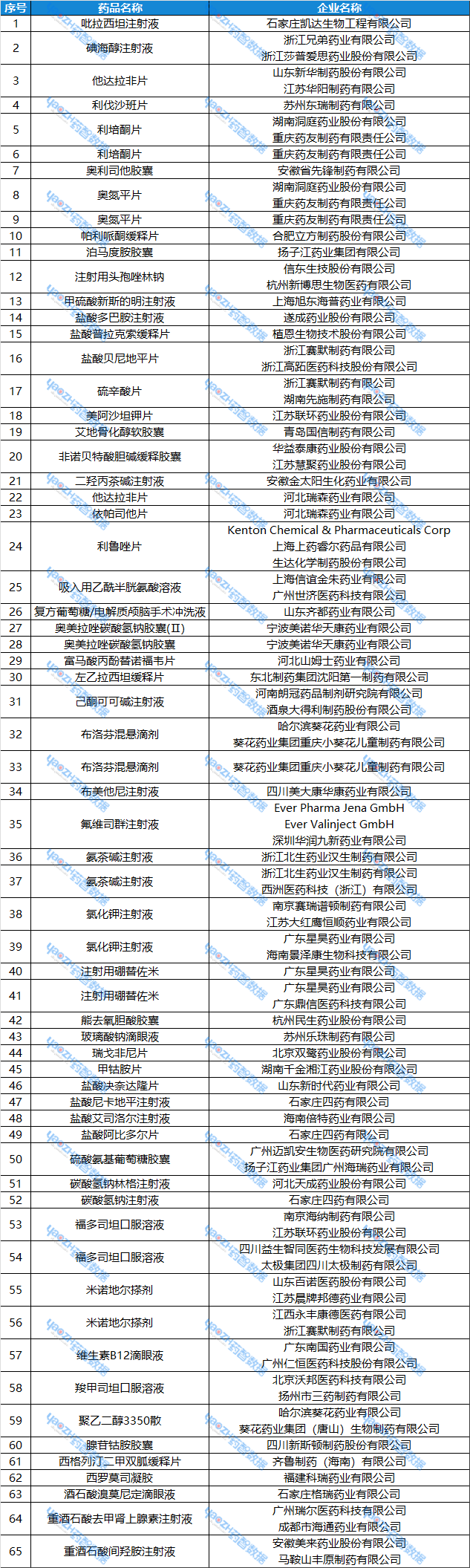
数据来源:药智数据——仿制药一致性评价分析系统
一致性评价受理情况3月24日~3月30日期间,共 70 个品种申报一致性评价,具体情况如下:
表 3:3月24日~3月30日,一致性评价申报情况
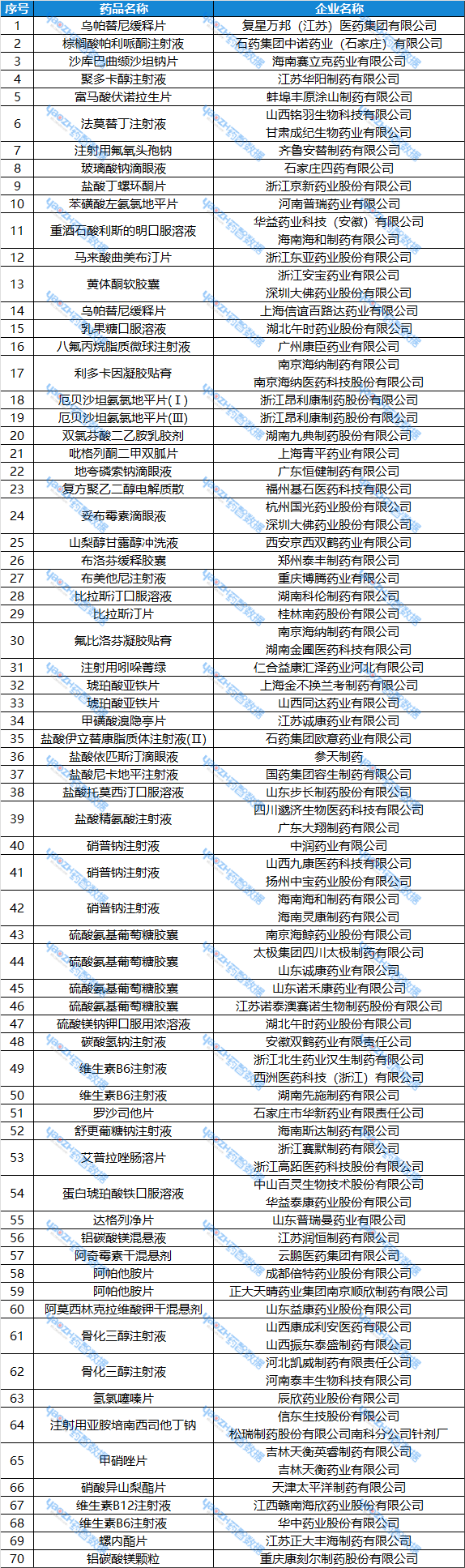
数据来源:药智数据——仿制药一致性评价分析系统



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57