4月7日,北京市医保局、市卫健委、市药监局等九部门印发《北京市支持创新医药高质量发展若干措施 (2025年)》的通知,涵盖临床试验、审评审批、生产流通、临床应用等8方面共32条措施,旨在推动创新药、创新医疗器械高质量发展,助力发展新质生产力。此通知自2025年4月7日起执行。32条措施要点归纳见文末表格。
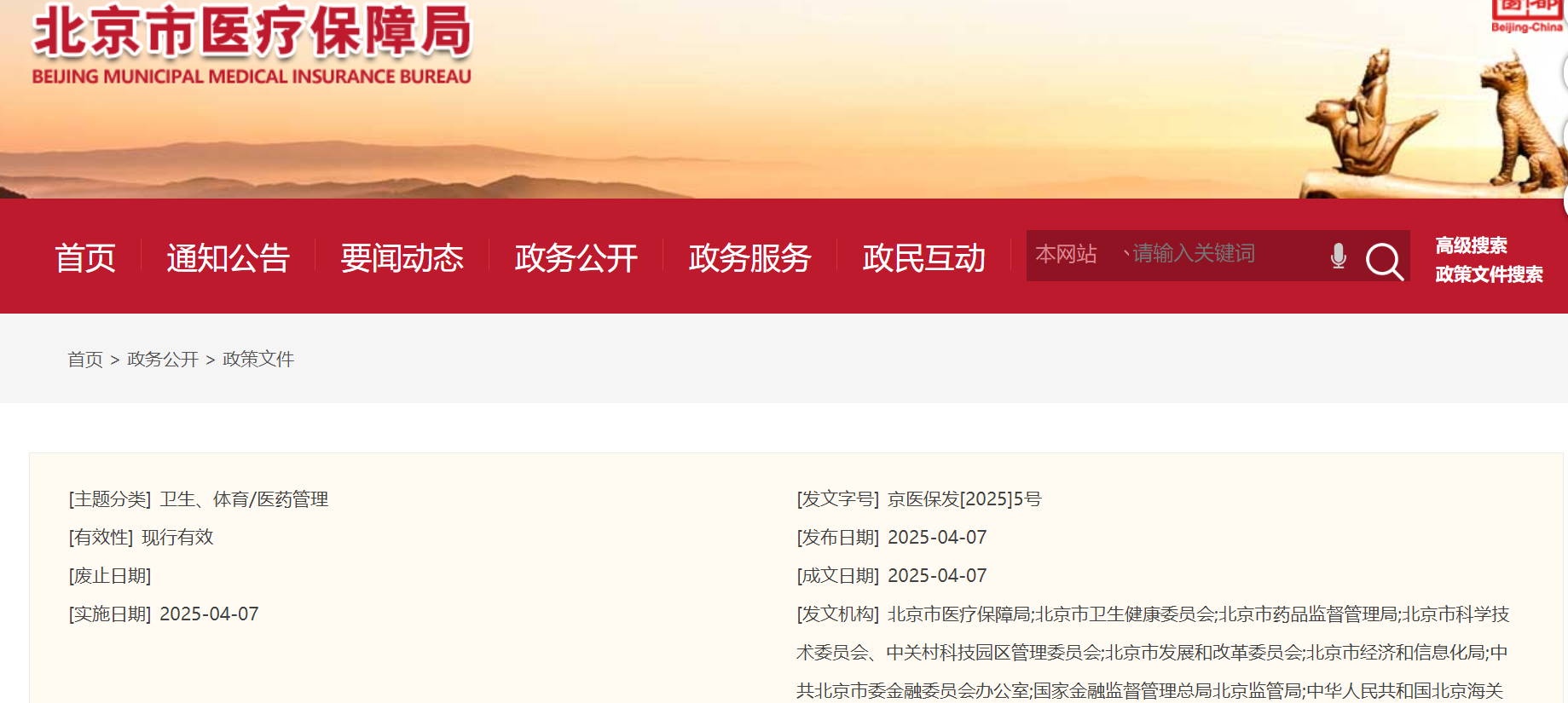
其中,在持续推动创新医药临床使用方面,国家医保谈判药品直接纳入全市定点医疗机构药品目录,医疗机构可通过“双通道”药店实现“应开尽开”。支持创新药目录药品通过绿色通道快速挂网,不计入基本医保自费率指标并通过“双通道”药店保障供应。支持药品批发企业整合资源,构建多仓协同物流管理模式。降低药店连锁门店面积标准,取消连锁总部对门店持股比例要求,鼓励零售药店连锁化发展。
创新药企向药监部门提交新药上市申请后,即可与医保、卫生健康部门沟通,提前做好医保准入和入院使用准备。对符合条件的创新药,不计入DRG病组支付标准,单独支付。鼓励1类创新药获批上市后1个月内快速挂网,在本市医疗机构率先使用并给予重点支持,可备案不计入基本医保自费率指标。对创新价值高但临床数据较少、实际证据不充分的药物,通过真实世界研究验证其临床价值的医疗机构给予资金支持。支持医疗机构组织编写干细胞等创新药使用专家共识,全年不少于5个。
在持续促进临床试验提质增效方面,将临床试验项目启动整体用时压缩至20周以内,多中心试验项目伦理审查互认率提高至90%以上。
深化创新药临床试验审评审批试点,将审批时限由60个工作日压缩至30个,创新药试点品种持续扩大,试点范围扩大到医疗器械。深化药品补充申请审评审批试点,将审评时限由200个工作日压缩至60个,争取将试点范围扩大至仿制药申请。
鼓励创新医药本地化生产。支持企业从国外引进重大药械品种,推动创新药械品种产业化落地和规模化应用,承接医疗机构院内制剂配制和向创新药转化,“一企一策”做好服务。
加强创新医药投融资支持方面,构建500亿元规模医药健康产业基金。新设100亿元规模医药并购基金。发挥好市级200亿元、区级100亿元两级生物医药投资基金协同作用。鼓励商业保险公司设立创新医药投资基金,吸引各类社会资本参与,带动100亿元以上规模社会基金投资医药领域。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57