摘要:中国仓鼠卵巢(CHO)细胞在重组蛋白和单克隆抗体制备中应用广泛,但传统培养依赖的胎牛血清(FBS)存在诸多问题,因此无血清培养基(SFM)的研发意义重大。本文系统总结了 CHO 细胞的应用优势、高密度表达策略,以及无血清培养基从传统血清替代物到微生物源物质的发展历程,并阐述了其作用机制,旨在为 CHO 细胞无血清培养基的开发提供理论指导 。
一、CHO 细胞:生物制药的 “明星细胞”
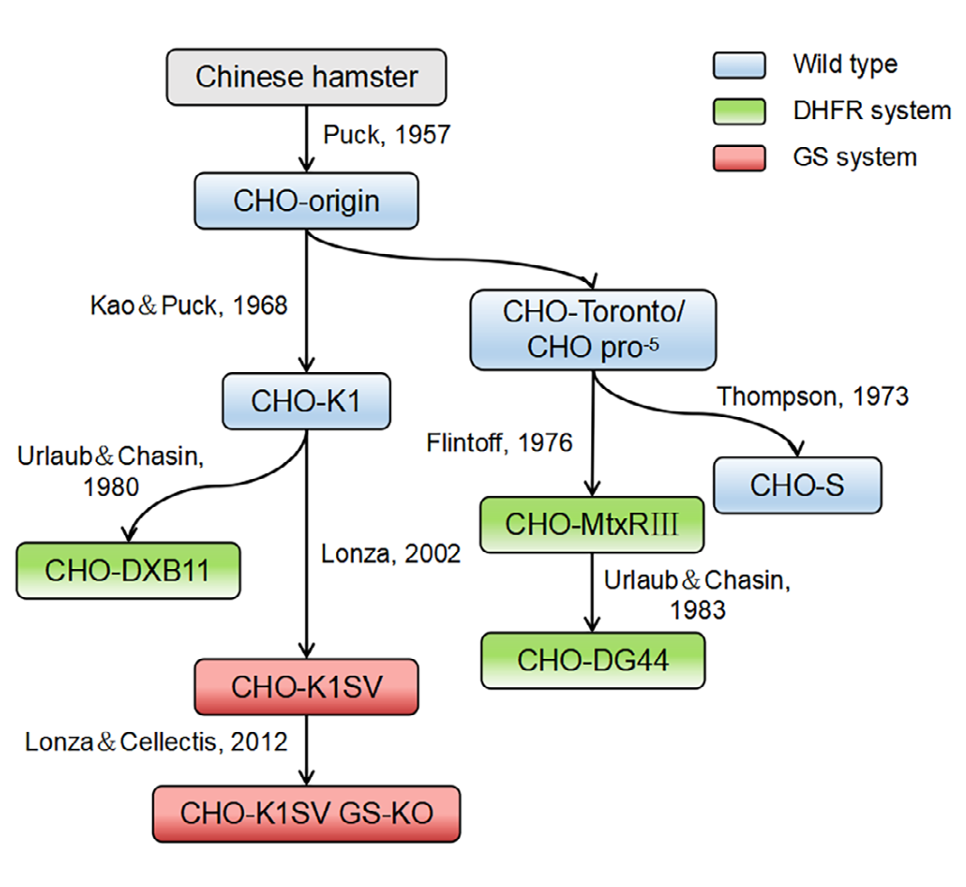
CHO 细胞的发展历程:CHO 细胞自 1957 年被首次分离出来后,就因其具有无限增殖的能力,成为了生物技术领域的 “宠儿”。1987 年,Genentech 公司首次利用重组 CHO 细胞生产人组织纤溶酶原激活剂,开启了哺乳动物细胞表达系统在生物制药领域的大规模应用 。之后,原始的 CHO 细胞经过不断驯化和基因工程改造,产生了如 CHO-K1、CHO-DXB11、CHO-DG44 和 CHO-S 等多种常用的细胞系(CHO 细胞发展谱系的图1,帮助读者更清晰地了解其发展脉络 )。
应用优势显著:CHO 细胞之所以在生物制药中应用广泛,是因为它有很多突出的优点 。首先,它具备精准的翻译后修饰能力,能产生与人细胞糖基化类似的重组蛋白,这使得生产出的生物药活性更高,与人体的相容性更好 。其次,它拥有强大的外源基因表达系统,像 DHFR 系统和 GS 系统,能利用外部压力提高重组蛋白的合成效率 。再者,CHO 细胞感染病毒的风险较低,产生的内源性蛋白少,便于目标蛋白的纯化和分离 。而且,它既能贴壁生长,也能悬浮生长,适合在生物反应器中进行无血清大规模培养 。
实现高效生产的策略:尽管 CHO 细胞有诸多优势,但目前其生产目标蛋白的效率与原核细胞和昆虫细胞表达系统相比还有提升空间 。科研人员主要从细胞工程、代谢工程和优化培养条件这几个方面入手,来提高重组蛋白的生产效率 。其中,培养基的优化至关重要 。比如,在氨基酸降解途径中产生的抑制性副产物会影响细胞生长,去除这些副产物并添加如迷迭香酸等生物活性化合物,能促进 CHO 细胞的增殖 。此外,调整培养基中的铁浓度也能提高蛋白产量,但需要注意避免铁过量导致蛋白变色 。不过,不同实验室和目标产品对培养基优化的结果差异较大,开发适合特定细胞系的新培养基仍是当前研究的重点 。
二、无血清培养基:CHO 细胞培养的新方向
FBS 的局限与无血清培养基的兴起:在 CHO 细胞的传统培养过程中,通常需要添加 5% - 20% 的 FBS 来维持细胞的生长和传代 。然而,FBS 存在不少问题,它的成分复杂,不同批次之间存在差异,这会导致培养基的质量不稳定,影响生物过程的可靠性和稳定性 。而且,FBS 还存在潜在的污染风险,可能携带内毒素、支原体、病毒等,并且全球 FBS 供应日益短缺,价格也比较昂贵,同时从动物福利的角度考虑,使用 FBS 也面临着伦理问题 。因此,开发无血清培养基迫在眉睫 。
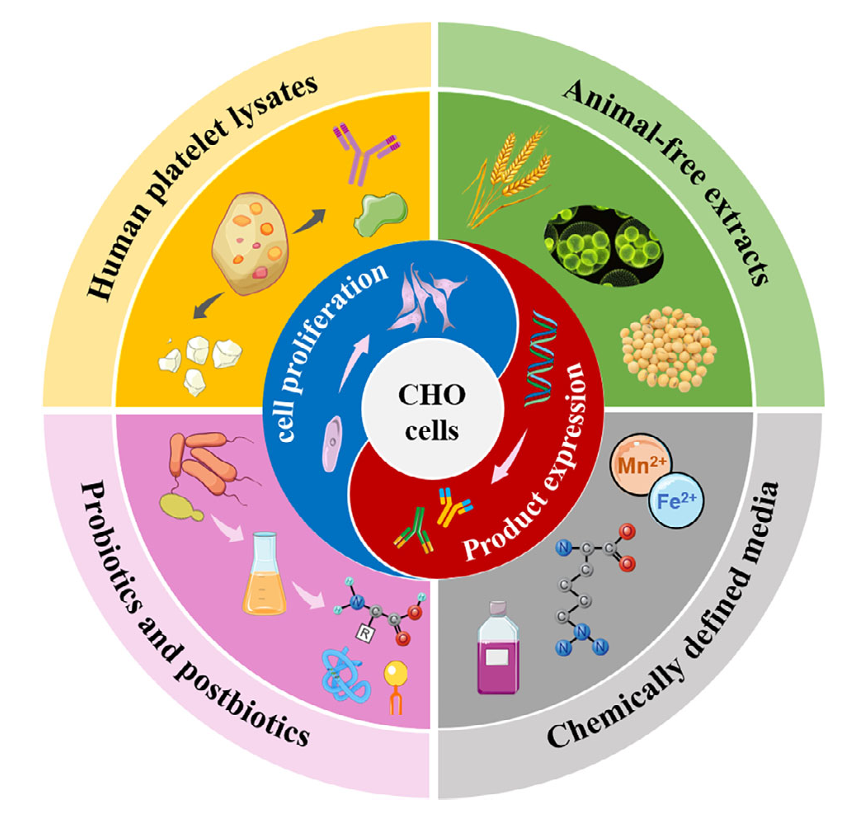
血清替代物的多样探索:为了替代 FBS,研究人员进行了大量的探索,开发出了多种血清替代物(血清替代物发展的图2,直观呈现各类替代物 )。
人血小板裂解物(HPLs):HPLs 曾被认为是很有潜力的血清替代物,它含有多种生长因子和细胞因子,能促进细胞增殖 。但 HPLs 存在个体和批次间的差异,成分复杂且具有异源性,还存在传播人类血源性病原体的风险,并且血液储备的短缺也限制了它的大规模应用 。
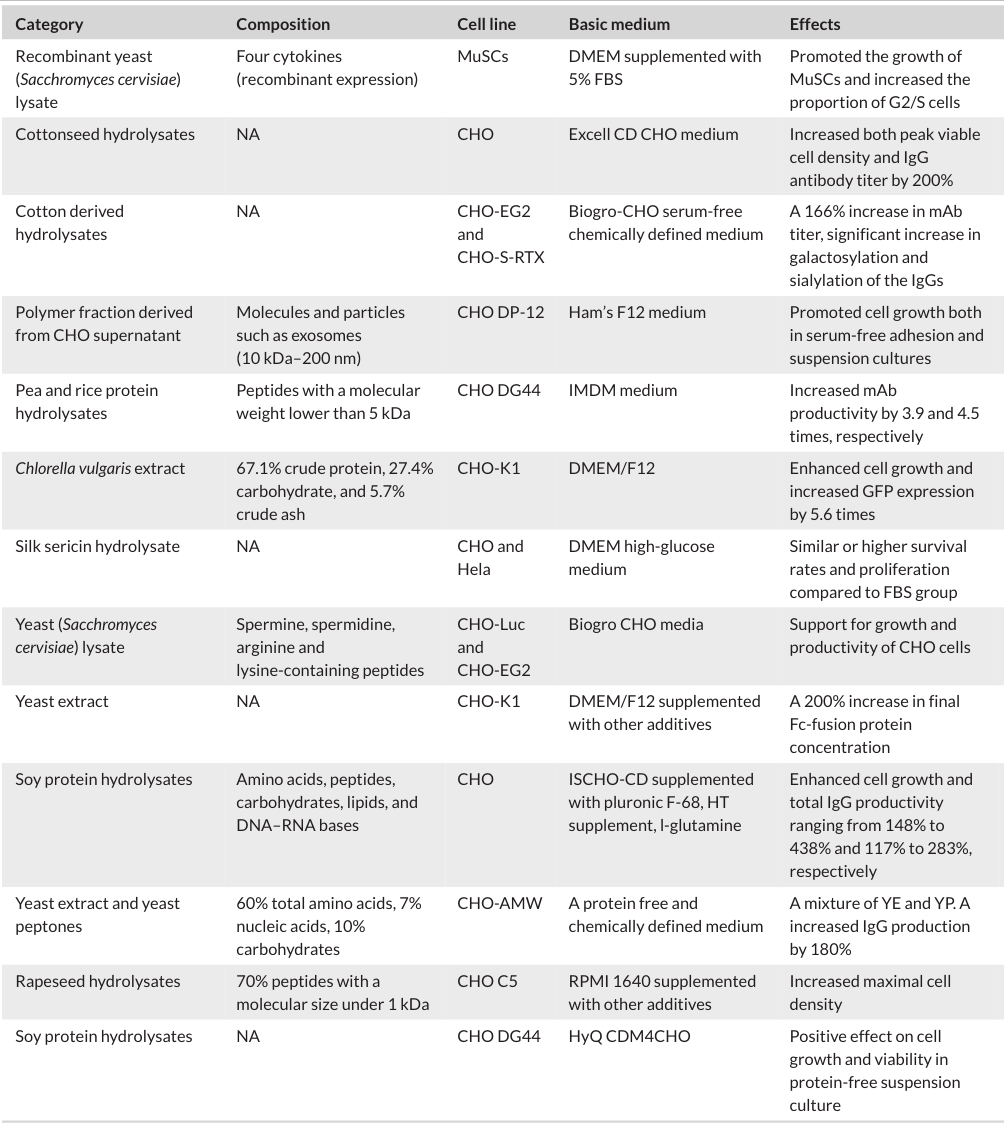
动物源无提取物:这类替代物来源于植物、微生物等非动物源,通过物理或化学方法提取得到,含有多种营养元素 。像大豆、小麦、棉籽水解物等,添加到无血清培养基中不仅能促进细胞增殖、提高蛋白产量,还能改善产品质量,比如影响抗体的电荷异质性和糖基化模式(动物源无提取物应用效果的表格 1,呈现具体数据 )。不过,它们的成分复杂,有效成分和作用机制还不完全清楚,需要进一步研究来减少批次间的差异 。
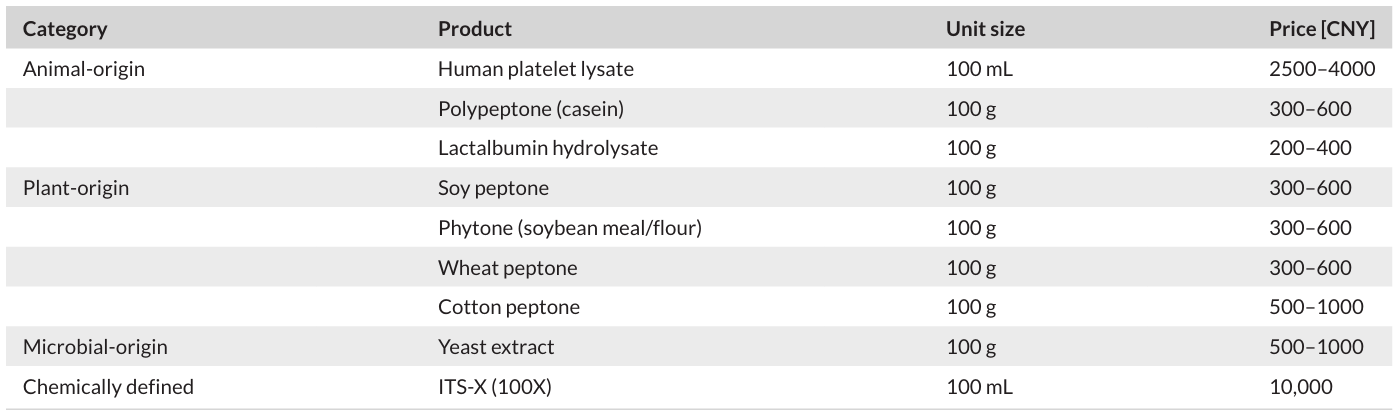
益生菌和后生元:益生菌是一类对宿主有益的微生物,后生元则是益生菌的代谢产物或灭活菌体 。研究发现,它们对细胞增殖和重组蛋白表达有促进作用。比如,乳酸菌的无细胞上清液(CFS)能刺激细胞生长和免疫细胞增殖,其中的一些成分,如蛋白质、多糖、短链脂肪酸等,具有抗氧化、免疫调节等功能 。酵母提取物作为常用的益生菌细胞裂解物,富含营养,能显著促进细胞生长和重组蛋白表达,但也可能会引起机体的不良反应,所以需要进行安全性评估 。从成本角度来看,许多植物源和微生物源的血清替代物成本较低,但由于来源和加工精度不同,其成本也有所差异(各类血清替代物成本对比的表格 2,让读者直观了解 )。
化学成分确定的培养基(CDM):CDM 的所有成分都是明确的,不含有动物源蛋白或提取物,具有质量稳定、批次间一致性好的优点,有利于细胞代谢分析和重组药物的安全生产 。早期的 F12 培养基是成功的 CDM 例子,但它在支持细胞高密度生长方面存在不足 。后来,通过将 F12 与 DMEM 按 1:1 混合,并添加激素、生长因子等添加剂,形成了 DMEM/F12 培养基 。随着技术发展,科研人员利用化学计量分析等方法,不断优化培养基配方,提高细胞密度、活力和重组蛋白产量。在优化过程中,常采用基于实验设计(DoE)原则的传统实验设计方法,结合各种统计方法和人工智能技术,来确定关键影响因素(统计方法和人工智能在 CDM 优化中应用的表格 3,呈现具体研究案例 )。
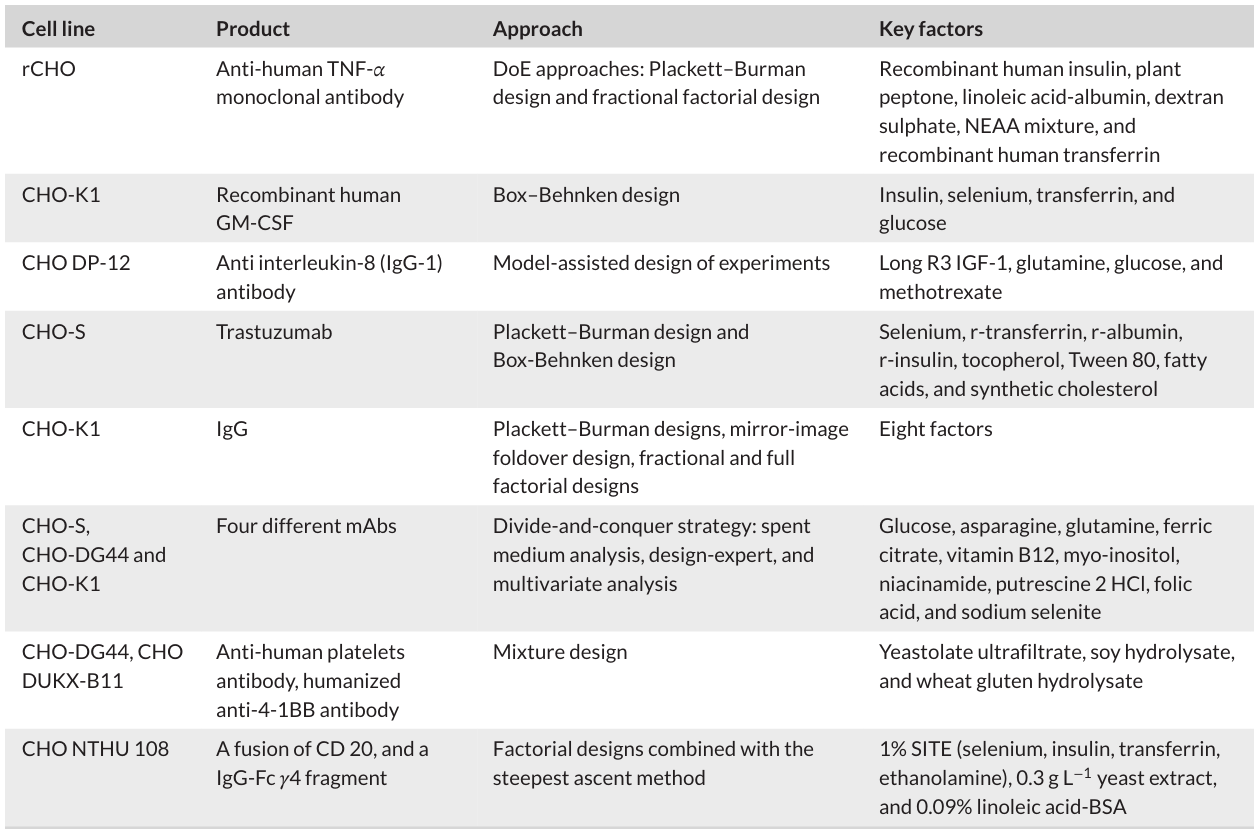
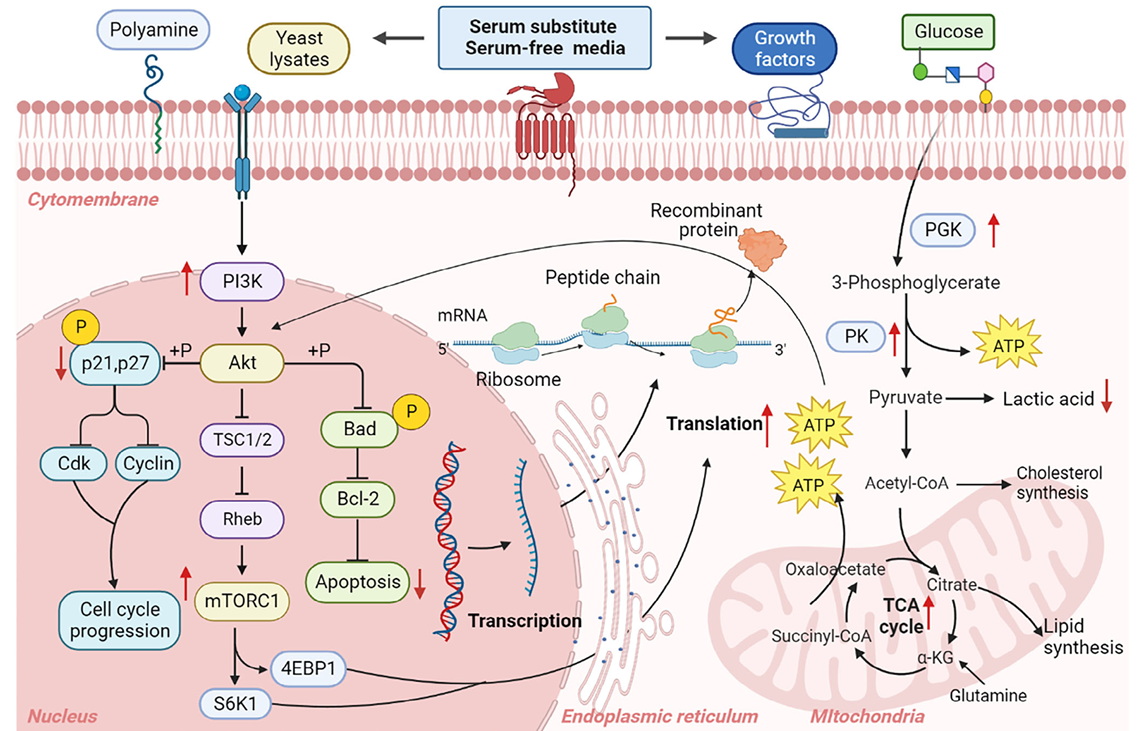
三、无血清培养基对 CHO 细胞的作用机制
调节细胞能量代谢:葡萄糖是细胞能量代谢的重要底物,但在无血清悬浮培养中,它往往是限制因素,需要不断补充 。一些动物源无提取物可以上调细胞能量代谢途径中的相关蛋白,加速糖酵解和三羧酸循环,为细胞生长和生物合成提供更多能量 。不过,葡萄糖代谢会产生乳酸,乳酸积累过多会对细胞有毒害作用 。使用乳糖、果糖等低碳分子糖类作为能量底物,能降低细胞渗透压,减少乳酸生成 。此外,像\(Mn^{2+}\)、\(Cu^{2+}\)、\(Zn^{2+}\)等微量元素,在细胞能量代谢和抗氧化应激中发挥着重要作用,它们可以作为酶的辅助因子,参与多种代谢过程 。
促进细胞生长和增殖:在 CHO 细胞的分批补料培养中,调节细胞周期和抑制细胞凋亡对细胞生长和提高细胞特异性生产力很关键 。酵母提取物可以通过抑制细胞周期蛋白(Cyc)和周期蛋白依赖性激酶(Cdk)的表达,使细胞周期停滞在 G0/G1 和 G2/M 期,同时维持培养基中丰富的营养环境,激活 mTOR 信号通路,促进细胞生长和蛋白合成 。多胺类物质,如精胺和腐胺,对 CHO 细胞的正常生长和增殖也至关重要,它们可以通过调节细胞周期和促进细胞对铁的吸收来发挥作用 。此外,一些益生菌,如双歧杆菌的裂解物,能通过激活 Wnt/β - catenin 和 PI3K/Akt/mTOR 信号通路,抑制肿瘤坏死因子诱导的细胞凋亡,促进肠道上皮细胞的增殖 。
促进重组蛋白合成和分泌:血清替代物和其他化学补充剂促进重组蛋白生产的机制是多方面的,涉及外源基因从转录、翻译到蛋白折叠、组装和分泌的整个过程 。动物源无提取物可以通过提高细胞活力和调节相关信号通路,来显著提高重组蛋白的合成效率 。一些小分子有机酸,如丁酸、戊酸等,可以通过表观遗传修饰激活转录因子,影响基因表达和调控 。翻译过程中,许多具有生长因子活性的氨基酸和寡肽可以上调 PI3K 和 mTOR 蛋白的表达,激活 PI3K/Akt/mTOR 信号通路,促进 RNA 在核糖体上的翻译和延伸 。此外,酵母提取物中的\(Ca^{2+}\)和富含精氨酸的寡肽可以与内质网分子伴侣结合,加速蛋白折叠和组装,促进蛋白分泌 。棉籽水解物则可以上调内质网中的热休克蛋白和伴侣蛋白,提高重组蛋白的合成和分泌效率 。
四、总结与展望
CHO 细胞在生物制药领域有着不可替代的地位,而开发新型无血清培养基是提高其培养性能和重组蛋白产量的关键 。目前的许多血清替代物和 CDM 在提高 CHO 细胞的整合活细胞密度(IVCD)和蛋白产量方面表现出色,它们通过改善细胞能量代谢、调节细胞周期、抑制细胞凋亡以及增强外源基因的转录、翻译和蛋白折叠分泌等过程发挥作用。
随着生物技术的不断进步以及人们对动物福利和环境保护意识的增强,动物源无提取物的开发和应用将获得更大的推动力。但研究人员仍需不断探索新型动物源无提取物,优化其成分和制备方法,提升性能、降低成本,并确保其安全性和有效性,以满足生物制药、细胞培养、组织工程和医学诊断等多领域的需求,使其性能更接近甚至超越传统动物血清,成为理想的血清替代品,为市场带来更多创新和机遇。
鉴于益生菌对健康的有益作用已得到广泛认可,探索其作为哺乳动物细胞血清替代品的潜力具有重要意义。同时,益生菌产生的后生元也展现出促进细胞生长和组织修复的生物活性。因此,需要深入鉴定和表征具有最佳促生长和增产特性的特定益生菌菌株及其代谢产物,明确其作用机制和活性成分,并通过数学统计或人工神经网络等方法,制定标准化方案和优化配方,将潜在的血清替代物和营养因子融入 CHO 细胞培养系统。
总体而言,探索包括动物源无提取物和后生元在内的更多血清替代物,对于以可持续且符合生物学规律的方式提升 CHO 细胞培养技术具有巨大潜力。这种创新方法有望在生物制药、基因治疗和细胞培养肉等多个领域发挥越来越重要的作用。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57