一、美国505(b)(2)路径概述及市场经验
(一)路径定义与分类
美国505(b)(2)路径源于1984年《Hatch-Waxman法案》,旨在为基于已上市药品活性成分进行剂型、配方、适应症等改良的产品提供简化审批通道。根据FDA分类,其涵盖新剂型(3类)、新复方(4类)、新适应症(6类)等10类注册申请。

美国化学药品新药上市许可申请(NDA)注册分类(图源:中国食品药品监管)
(二)市场表现
市场规模:截至2023年,美国505(b)(2)产品累计批准超2500个,2022年销售额达1050亿美元,占医药市场17%。
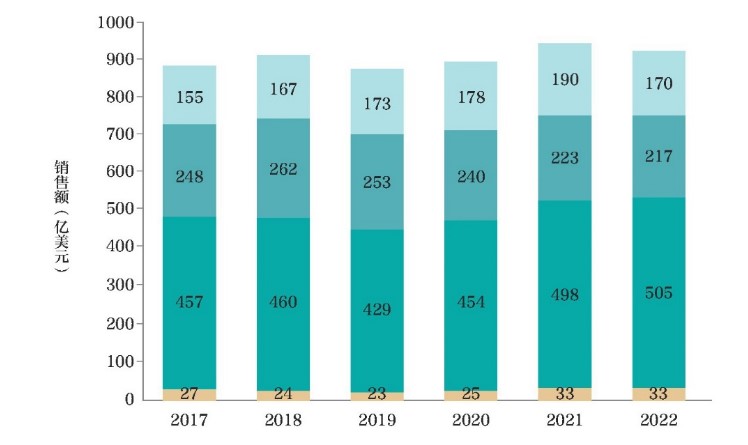
2017-2022年美国2-5类505(b)(2)产品市场销售额情况(图源:中国食品药品监管)
(三)成功要素
创意设计:如环孢素滴眼液(Restasis)通过免疫调节机制解决干眼症痛点。
技术壁垒与专利保护:复杂制剂(如亮丙 瑞林微球、奥曲肽微球)因仿制难度高生命周期长。
临床优势:脂质体阿霉素降低心脏毒性,白蛋白结合型紫杉醇提升疗效。
市场定位精准:原研企业通过品牌延伸(如利培酮口崩片)延长产品生命周期。
(四)审评特点与挑战
审评效率:平均审评周期18.4个月,30%产品依赖临床药理学数据获批。
市场集中度:前50名产品占总销售额72%,原研企业占据主导地位,中小企业面临推广和医保准入压力。
二、中国改良型新药政策法规与注册分类
(一) 政策沿革
2015年国家启动药审改革,于2016年《化学药品注册分类改革工作方案》首次明确改良型新药(2类)定义,要求“具有明显临床优势”。2020年《药品注册管理办法》细化优先审评、附条件批准等加速通道。
《化学药品注册分类改革工作方案》发布公告(图源:国家药品监督管理局)
(二) 注册分类与要求
2.1类:新活性成分(如异构体、新盐),需证明临床优势。
2.2类:新剂型、新处方工艺,需通过生物等效性或临床试验验证。
2.3类:新复方制剂,强调组分协同效应。
2.4类:新适应症,需独立临床试验支持。
相关数据显示,中国2.2类(新剂型)和2.4类(新适应症)改良型新药占比超90%,但存在同质化竞争、研发门槛高等问题。其中,在2016-2021年化学药改良型新药,无论是申请临床试验还是申请生产,申报的注册分类大部分集中在2.2类和2.4类,2.1类和2.3类数量较少,甚至为0。

2016-2021年化学药改良型新药申报情况(图源:中国新药杂志)
(三) 受理与获批特点(2016-2023年)
申报趋势:临床试验申请(IND)1496个,生产申请(NDA)278个,获批165个。
分类分布:2.4类(新适应症)占比62%,2.2类(新剂型)29%,2.1类和2.3类合计不足10%。
治疗领域:抗肿瘤药(38%)、神经系统用药(18%)、抗感染药(12%)为研发热点。
剂型创新:缓控释制剂(19.7%)、注射用无菌粉末(16.4%)为2.2类主流方向。
三、中美对比:政策与市场的异同
(一) 政策差异
临床优势要求:中国强调“明显临床优势”为获批前提,美国更依赖市场验证。
数据保护:美国对含临床试验的产品提供3年数据独占期,中国尚无明确条款。
审评灵活性:美国通过新药临床试验申请前(Pre-IND)会议与美国 FDA建立
有效的沟通以尽量豁免或减免临床试验。相比较而言,中国的审评标准相对严格。
(二) 市场表现差异
企业类型:美国以原研企业主导,中国仿制药企转型为主。
产品类型:美国新剂型(3类)占比高,中国新适应症(2.4类)占主导。
竞争格局:中国存在“扎堆申报”现象(如紫杉醇胶束),美国市场集中度高。
四、中国改良型新药研发现状与挑战
(一) 现状分析
政策驱动明显:抗肿瘤、神经系统用药符合“健康中国”战略导向。
技术积累不足:高端制剂(如脂质体、微球)占比低,依赖进口技术。
同质化竞争:2021年多家企业集中申报丁苯酞注射液,导致审批延迟。
(二)核心挑战
研发门槛高:2.1类(新盐/异构体)需大规模临床试验,中小企业难以承担。
市场回报不确定:部分产品临床优势不显著,难以突破仿制药替代压力。
专利布局薄弱:剂型改良专利易被规避,技术壁垒不足。
五、美国经验对中国的启示
美国经验表明,强调临床优势、注重专利保护和市场定位是成功关键。具体来说,美国经验对中国的启示主要表现在以下几个方面:
(一) 研发策略优化
聚焦差异化创新:避免简单剂型改良,探索联合用药(如右美沙芬+奎 尼丁)、新型给药途径(透皮贴剂)。
强化专利保护:布局制剂工艺、用途专利,延长市场独占期。
(二) 政策建议
完善数据保护制度:对含临床试验的改良型新药给予数据独占期。
优化审评灵活性:建立Pre-IND沟通机制,允许部分试验豁免。
引导资源分配:通过优先审评鼓励抗感染、儿科用药等短缺领域。
(三) 企业行动方向
与原研合作:借鉴美国模式,中小企可联合原研企业开发升级产品。
临床需求导向:从患者依从性(如口崩片)、安全性(如脂质体)切入设计产品。
因此,中国还需进一步优化政策引导,鼓励差异化创新,提升技术壁垒,以实现改良型新药的高质量发展。
结语
总体而言,改良型新药是连接仿制药与创新药的重要桥梁。美国505(b)(2)路径通过40年发展,形成以临床价值为核心的市场生态;中国虽起步较晚,但政策红利显著,申报量快速增长。未来,中国需进一步平衡监管严格性与审评灵活性,鼓励企业从“为改而改”转向“以需定改”,同时加强国际合作与技术转化,有望进一步推动改良型新药成为医药创新的新增长极!
参考资料:
1.国家药品监督管理局药品审评中心, https://www.cde.org.cn/
2.U.S. Food and Drug Administration, https://www.fda.gov/
3.总局关于发布化学药品注册分类改革工作方案的公告(2016年第51号), https://www.nmpa.gov.cn/xxgk/ggtg/ypggtg/ypqtggtg/20160309151801706.html
4.Sah B, Kumar S. Regulatory Foundation of 505(B)(2) Application in US FDA[J]. IJMAR. 2023,11(4):1-7.
5.Salminen WF, Aloba O, Drew A, Marcinowicz A, Huang M. US FDA 505(b)(2) NDA clinical, CMC and regulatory strategy concepts to expedite drug development. Drug Discov Today. 2023, 28(7):103618.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57