时间是生命现象的基本维度。在约 30 亿年的生命演化长河中,膜脂系统协同环境演绎了适应性变化:从原始细胞由简单两亲性分子自组装形成的半透性膜结构,逐步演化为真核细胞具有高度选择性的磷脂双分子层系统;从变温生物依赖环境温度变化的膜脂相变被动调节机制,发展为恒温生物整合脂代谢网络和膜蛋白调控的精准温度适应系统;从单细胞生物作为独立代谢单元,进化出多细胞生物基于膜系统的复杂细胞间通讯和组织特异性分化机制。
与单羧酸自组装的原始脂质体相比,双脂肪酰基结构的磷脂分子能够形成更稳定的囊泡结构,显著降低膜通透性。这些特性强化了生命单元与外部环境的界限,成为早期生命形式面临的重要选择压力。由此引发一个重要的科学思考:正如地球自转公转形成的昼夜节律对生命活动产生深远影响,磷脂分子在生命进化过程中展
现的选择优势,是否也在生命单元遗传复制周期的时间维度上隐藏着尚未被发现的基本规律?
2025年4月14日,浙江大学生命科学研究院叶存奇团队在 Nature Chemical Biology 期刊发表了题为:Temporal oscillation of phospholipids promotes metabolic efficiency 的研究论文。
该研究首次证实了真核细胞存在内源性磷脂合成节律,解析了不同甘油磷脂分子的相位特异性振荡特征,以影响膜流动性,并进一步阐明了驱动该振荡节律的关键调控机制。这项研究不仅揭示了细胞关键物质通过自调控系统影响熵变应对能量代谢的时间机制,更为我们理解细胞节律、生物膜演化、细胞对环境感受及响应机制提供了全新的视角。

技术挑战与突破
细胞生长过程中磷脂分子的精准时序调控始终是困扰生物学家的重要科学谜题。该研究面临三个关键性技术挑战:
1)磷脂分子存在极高的结构复杂性——哺乳动物细胞中含有上万种磷脂分子,根据极性头基差异可分为磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)和磷脂酰肌醇(PI)等多个大类,每类又包含不同链长和饱和度的亚型。尽管现代质谱技术的检测灵敏度能实现部分高丰度磷脂的单细胞检测,但仍难以完成全磷脂组的高覆盖、高精度定量分析。
2)常规细胞培养体系存在固有的群体异质性,包括细胞周期不同步、代谢状态差异、微环境不均一性等,导致检测结果只能反映群体平均水平。
3)磷脂生物合成途径对营养、温度、酸碱度等环境因素异常敏感,这些干扰使得研究者难以准确区分内源性节律信号与环境影响。
研究团队创新性地选用酿酒酵母(Saccharomyces cerevisiae)作为模式生物,通过精密控制的恒化培养系统(Chemostat culture system)实现了技术突破。该体系通过稳定营养供给、严格维持培养温度、pH 值等环境因素,成功建立了细胞代谢与细胞周期高度同步化的细胞群体。酵母细胞与哺乳动物在磷脂代谢通路上具有高度同源性,而酵母磷脂组分相对简单,仅包含百余种,主要源于相对单一的脂肪酸链组成及其化学键类型。同时,酵母模型的同步化培养不仅消除了环境和异质性干扰,还实现了近似单细胞水平的研究体系。在此基础上,基于研究团队开发的高灵敏度的精准定量脂质分析技术,团队首次实现了对真核细胞内源性磷脂随细胞周期的动态变化的精准解析。
细胞“隐秘时钟”,精准调控生命基石——磷脂代谢!
研究团队在细胞分裂与代谢周期同步的系统中观察到,不同磷脂分子的胞内含量呈现出精细的时间性波动,揭示了其在时间维度上的系统性分隔。具体而言,作为细胞中膜系统最主要的磷脂类型,PE 和 PC 表现出独特的反相振荡模式,且各自的振荡特征不受脂肪酸链组成影响(图1)。与之形成对比,磷脂PI和PS的丰度振荡则呈现出显著的时间偏移,该偏移与其脂肪酸链的链长度和不饱和度明显相关(图1)。这种在细胞代谢周期中表现出的分子特异性差异振荡规律与膜物理性质的动态变化高度吻合,提示细胞可能通过准确调控脂质代谢的时序性,在膜结构形成和重组过程中实现能量代谢的最优化。
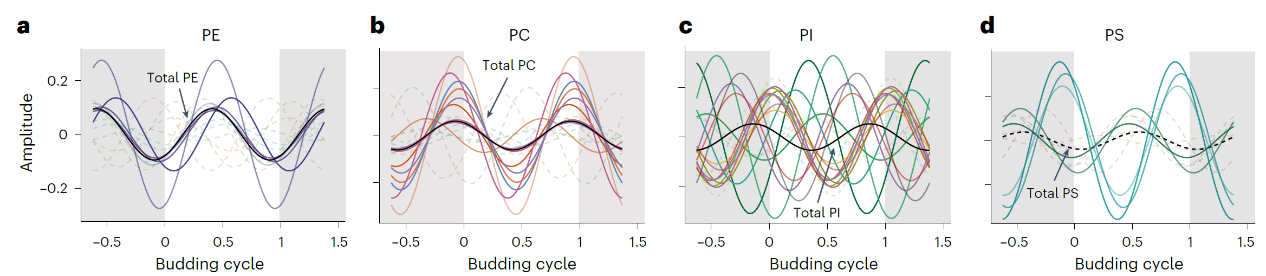
图1. 磷脂振荡周期曲线
进一步的机制研究揭示,磷脂丰度的节律性波动受到双重调控:
其一,磷脂代谢相关基因的程序性表达调控是关键因素。研究团队发现,PS-PE-PC 的合成代谢通路是维持磷脂周期性振荡的核心机制。Henry调控环路通过响应磷脂酸(PA)丰度振荡的变化,实现对该代谢通路基因表达的时间差异性调控,进而维持磷脂合成的精确时序性。鉴于PA同时作为磷脂合成的前体和转录调控信号分子的双重功能,Henry 调控环路与 PA 丰度振荡之间的负反馈机制强调了 PA 在反映磷脂与甘油三酯(TAG)的平衡状态以及维持磷脂内源性振荡模式中的重要作用。
其二,借助创新性设计的同位素脂质追踪与反向追踪技术,研究团队证实磷脂 PE 与 PC 细胞含量的周期性振荡依赖于 TAG 作为关键的脂质存储库进行生物合成转化,而 PI 与 PS 则主要通过从头合成途径进行。
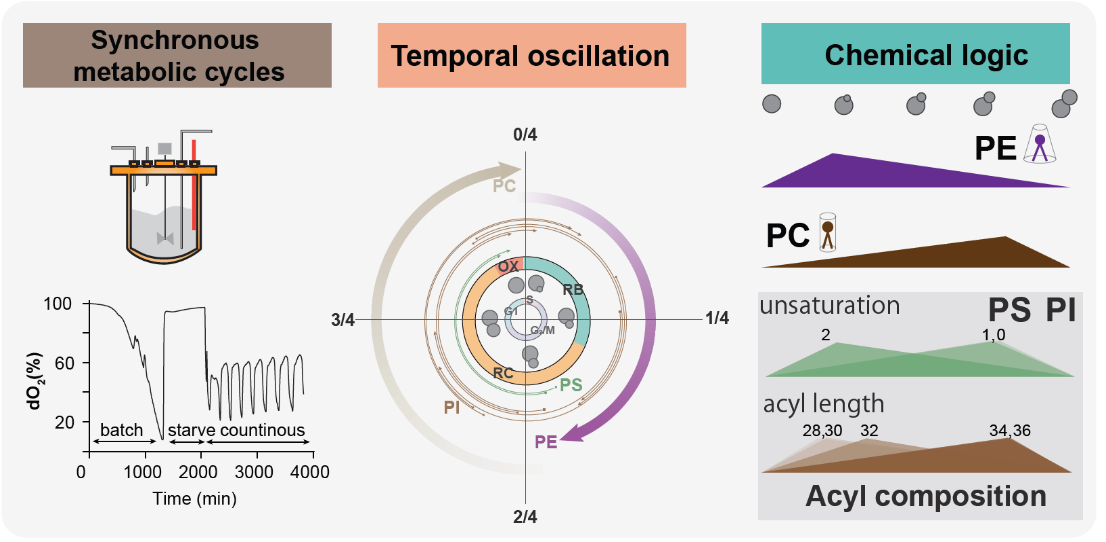
图2. 磷脂时序性模式图
综上所述,研究团队利用真核单细胞酵母模型,首次捕捉到了磷脂合成的内源性节律,并提出该节律能够整合环境信号,从而调控磷脂合成的时间进程,最终优化细胞的代谢效率。这一新型代谢节律的阐明,为深入理解细胞代谢与生物能量状态、膜生物学、细胞器生物学以及细胞分裂生长之间的相互关系提供了全新的研究视角。
浙江大学生命科学研究院博士研究生杨森、王远为论文共同第一作者,浙江大学生命科学研究院研究员叶存奇为通讯作者。博士研究生黄思思、张潼、浙江大学生命科学研究院研究员蒋超、资深研究员徐平龙为该研究提供了重要支持。
论文链接:
https://www.nature.com/articles/s41589-025-01885-5



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57