摘要:双特异性抗体(bsAbs)作为一种新型抗癌疗法,能同时靶向两种不同抗原,通过多种独特机制发挥作用,为癌症治疗带来新希望 。目前,部分 bsAbs 已获批用于血液系统恶性肿瘤和部分实体瘤的治疗,但在临床应用中仍面临毒性管理和耐药等挑战 。本文将详细介绍 bsAbs 的设计原理、作用机制、临床应用现状、局限性以及未来发展方向,旨在让读者全面了解这一领域的研究进展和应用前景 。

一、双特异性抗体:癌症治疗的新希望
癌症严重威胁人类健康,传统治疗手段存在诸多局限 。双特异性抗体(bsAbs)作为一种新型治疗药物,能同时瞄准两个不同的抗原或抗原表位,具有独特的结构和多样的设计可能性,这使其作用机制丰富多样,比如引导免疫细胞攻击肿瘤细胞,或阻断肿瘤相关的信号通路 。目前,已有 11 种 bsAbs 获得监管批准用于癌症治疗,其中 7 种用于血液系统恶性肿瘤,4 种用于部分实体瘤,还有大量相关临床试验正在进行 。不过,在临床使用过程中,bsAbs 也面临着细胞因子释放综合征(CRS)、免疫效应细胞相关神经毒性综合征(ICANS)等不良反应的挑战 。接下来,我们深入了解一下 bsAbs 的具体情况 。
二、双特异性抗体的设计奥秘
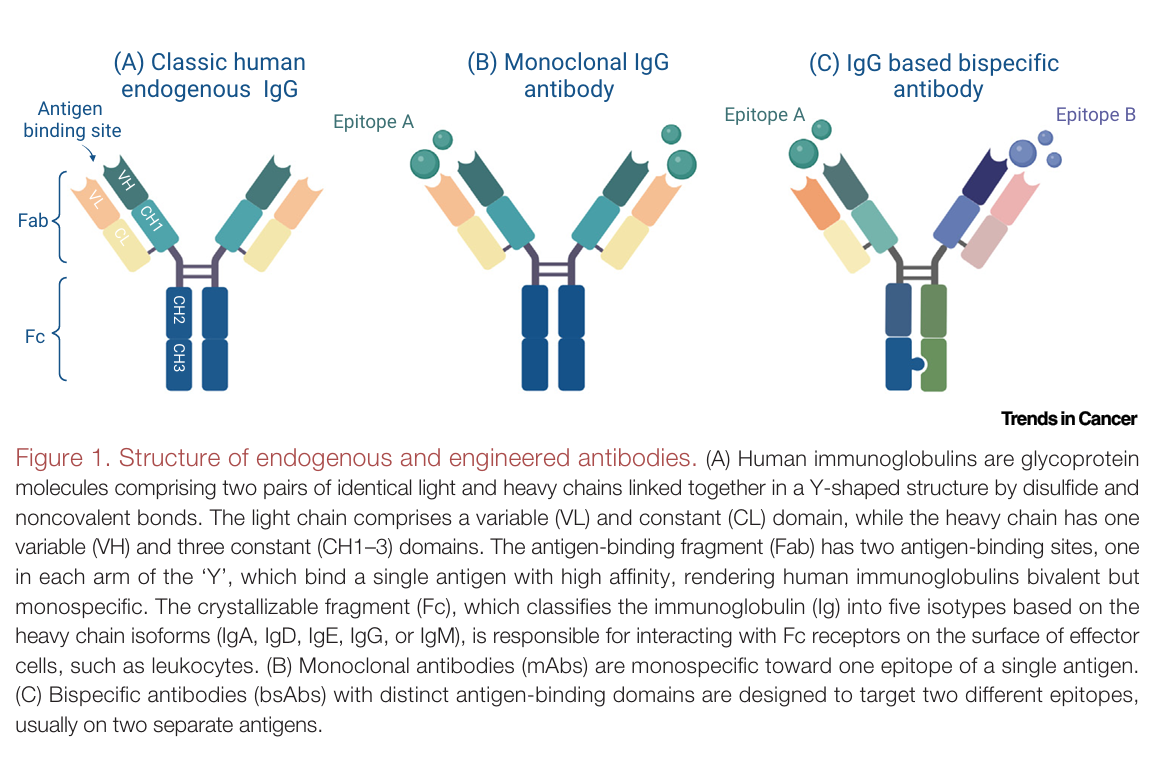
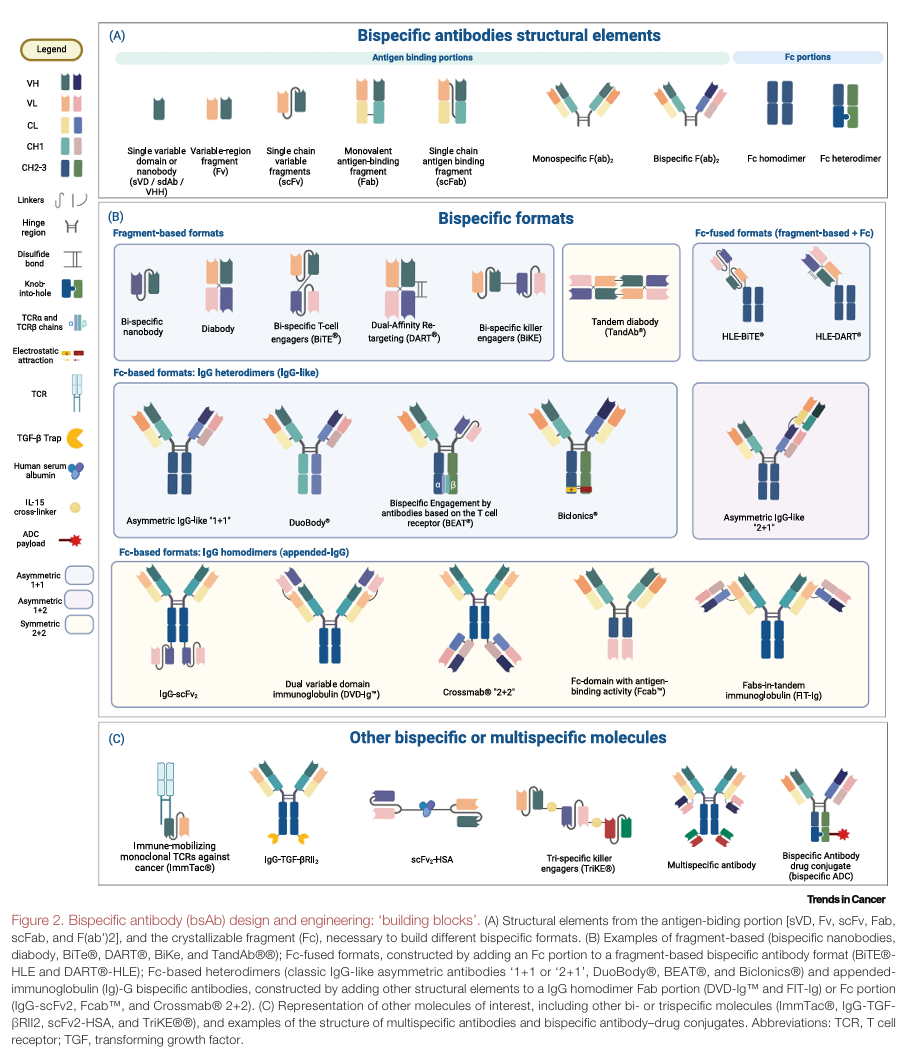
结构优化与功能调节:bsAbs 的设计灵感来源于内源性二价抗体,目前主要分为基于 Fc 区域和基于片段的两大类(原文 Figure 1 和 Figure 2,帮助读者直观理解内源性抗体、单克隆抗体和双特异性抗体的结构差异,以及 bsAbs 的不同设计类型) 。Fc 区域在抗体中负责介导效应功能,但也可能引发一些不良影响 。因此,人们通过选择不同的 IgG 亚类或进行氨基酸替换等方式来调整 Fc 区域的功能,以平衡其免疫激活和不良作用 。比如,选择 IgG2 或 IgG4 亚类可以降低与 FcγR 的结合,减少非特异性免疫细胞激活;而去除或减少 Fc N - 聚糖中的核心岩藻糖,则能增强与 FcγRIIIa 的结合,提升 ADCC 活性 。
药代动力学与半衰期优化:bsAbs 的药代动力学特性和半衰期对其疗效有着重要影响 。基于 Fc 的 bsAbs 可以通过与新生儿 Fc 受体(FcRn)结合,实现抗体的循环利用,延长半衰期 。而基于片段的 bsAbs 虽然具有较高的组织渗透性,但半衰期较短 。为了解决这一问题,人们尝试了多种方法,如对基于片段的 bsAbs 进行修饰,使其与其他分子融合,像与人类血清白蛋白融合,或者为经典的 BiTEs 添加 Fc 区域,从而延长其在体内的停留时间。
抗原结合价态的选择:bsAbs 根据抗原结合位点的数量可分为对称和不对称两种类型 。对称 bsAbs 通常具有四价结构,能平衡地靶向两个抗原;不对称 bsAbs 则提供了更灵活的靶向选择,如 1 + 1 或 1 + 2 等不同的结合形式。选择合适的抗原结合价态,有助于提高 bsAbs 对肿瘤细胞的靶向性和治疗效果 。
降低 “脱靶毒性”:“on - target off - tumor” 毒性是 bsAbs 面临的一个重要问题,即抗体与肿瘤细胞和正常组织上的抗原都结合,从而产生不良影响 。为了改善这一情况,研究人员通过优化不同结合位点的特异性和亲和力,使 bsAbs 更倾向于与肿瘤细胞结合 。例如,ABL503 通过同时靶向 PD - 1 和 4 - 1BB,降低了肝脏毒性;TG - 1801 对 CD19 和 CD47 的不同亲和力设计,减少了对正常细胞的影响。此外,将 bsAbs 设计成在肿瘤微环境中激活的前药,也是减少对健康组织影响的一种策略 。
三、双特异性抗体的作用机制大揭秘
免疫细胞激活:双特异性 T 细胞衔接器(TCEs)能够同时结合 T 细胞和肿瘤细胞,激活 T 细胞,使其释放穿孔素和颗粒酶,从而杀死肿瘤细胞 。此外,TCEs 还能引发 T 细胞的增殖和迁移,重塑肿瘤微环境(TME)(原文 Figure 3,展示双特异性 T 细胞衔接器等 bsAbs 的作用机制示意图,帮助读者理解 TCEs 如何发挥作用)。除了 T 细胞,自然杀伤(NK)细胞也能被双特异性杀伤细胞衔接器(BiKEs)引导至肿瘤部位,发挥抗肿瘤作用 。例如,AFM13(CD30xCD16A)在治疗 CD30 + 淋巴瘤的临床试验中展现出显著的抗肿瘤活性 。
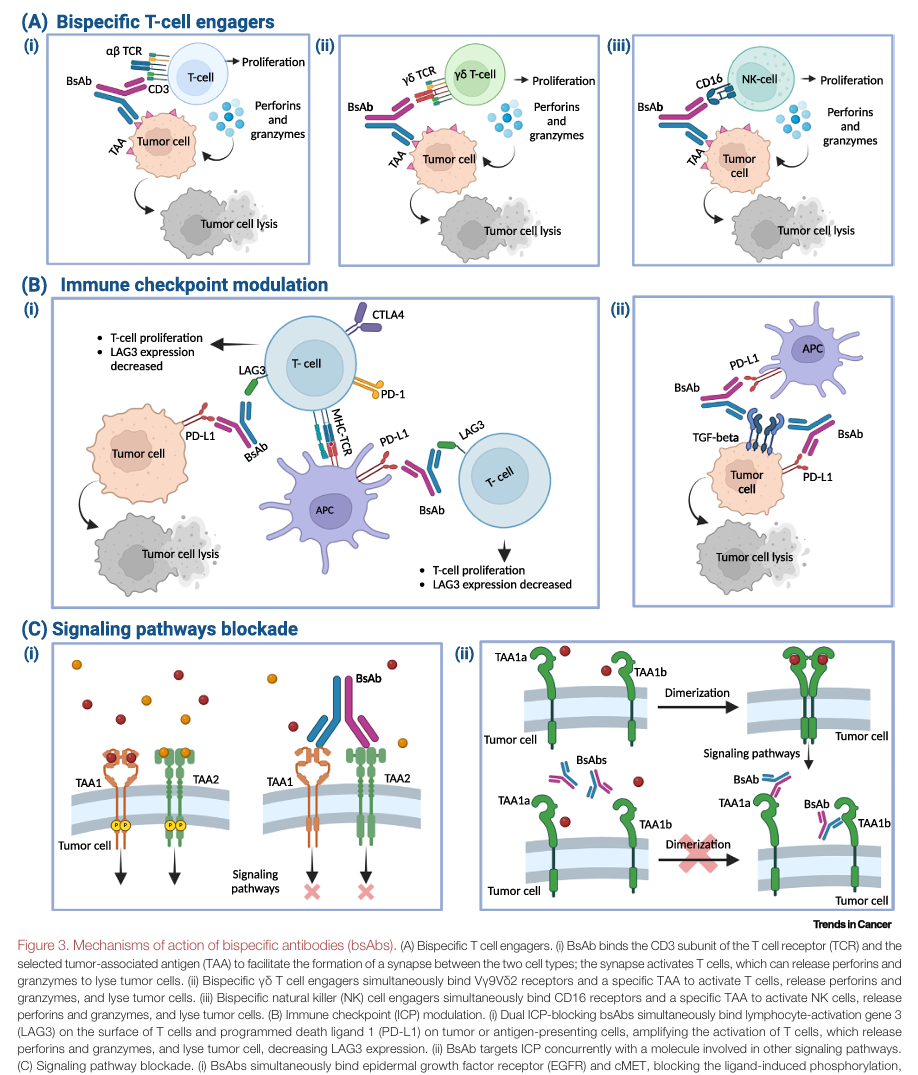
免疫检查点调节:免疫检查点调节疗法是癌症治疗的重要突破,但也存在一些问题 。双特异性抗体可以同时阻断两个免疫检查点受体,如 PD - 1 和 CTLA - 4,相比于单克隆抗体组合,它能更精准地靶向肿瘤浸润淋巴细胞(TILs),增强抗肿瘤免疫反应,同时减少 “脱靶” 毒性 。例如,volrustomig 和 cadonilimab 都能优先靶向共表达 PD - 1 和 CTLA - 4 的 TILs 。此外,bsAbs 还可以结合共刺激受体,进一步激活 T 细胞,但如何控制 T 细胞的激活程度,使其在安全有效的范围内,仍是一个挑战 。
信号通路阻断:bsAbs 可以通过阻断肿瘤细胞的关键信号通路来抑制肿瘤生长 。它们可以同时靶向两个不同的抗原或同一抗原的不同区域,阻止受体 - 配体相互作用,促进受体内化和降解,从而抑制下游信号传导 。比如,amivantamab 通过阻断 EGFR 和 cMET 信号通路,有效治疗 EGFR 突变的非小细胞肺癌;zanidatamab 则通过同时靶向 HER2 的不同结构域,抑制 HER2 信号传导,展现出强大的抗肿瘤活性 。
四、双特异性抗体的临床应用成果
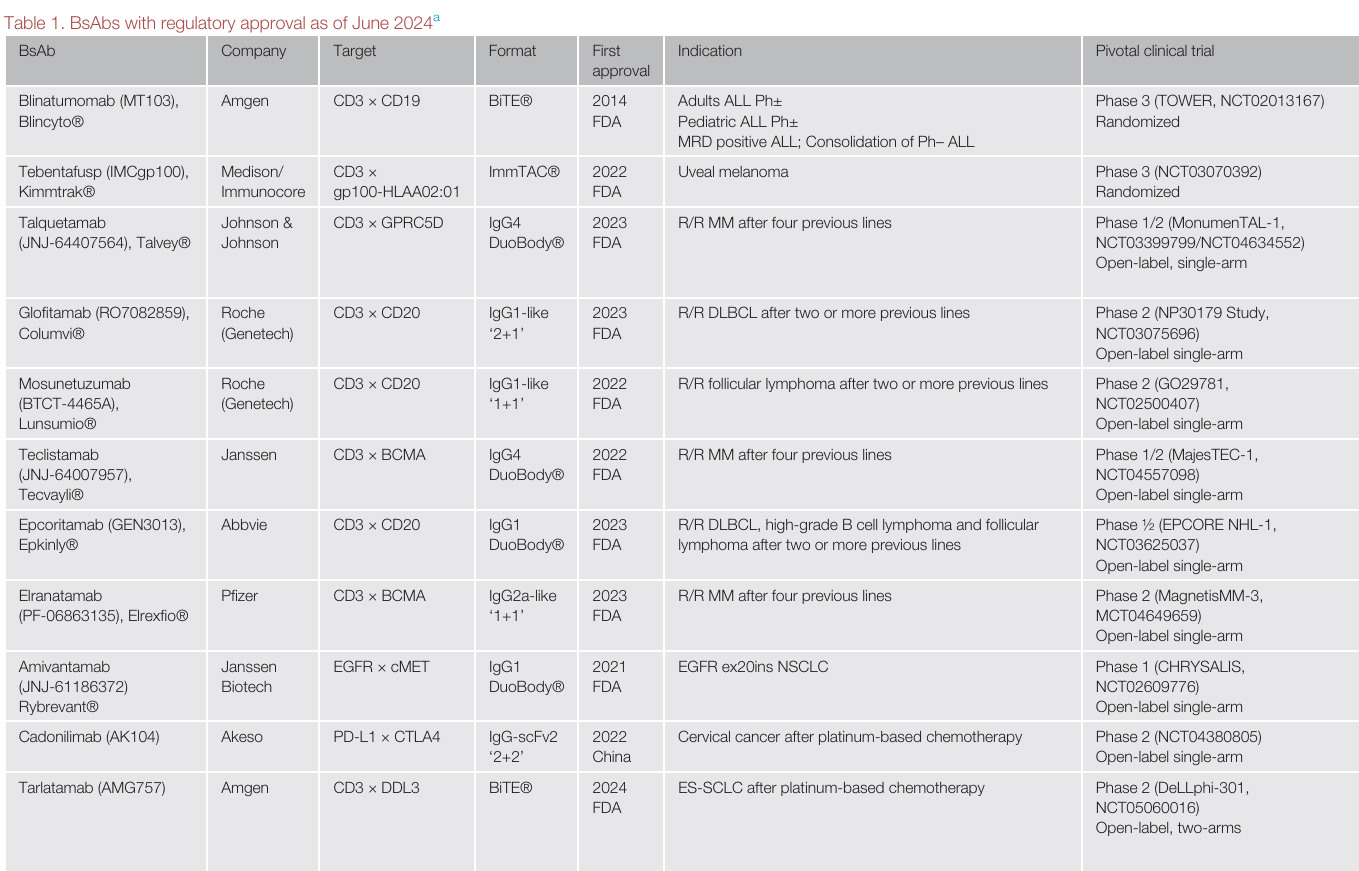
血液系统恶性肿瘤:在血液系统恶性肿瘤的治疗中,bsAbs 取得了显著的成效 。以急性淋巴细胞白血病(ALL)为例,blinatumomab 在治疗复发 / 难治性 B 细胞 ALL 方面表现出色,不仅在成人和儿童患者中都有较高的完全缓解率,还获得了 FDA 的多项批准,用于不同阶段的 ALL 治疗 。在 B 细胞非霍奇金淋巴瘤(B - NHL)的治疗中,glofitamab、epcoritamab 和 mosunetuzumab 等针对 CD20 的 TCEs,在复发 / 难治性患者中展现出良好的疗效,显著提高了完全缓解率 。对于多发性骨髓瘤(MM),teclistamab、elranatamab 和 talquetamab 等靶向特定抗原的 bsAbs,为复发 / 难治性患者带来了新的希望,延长了患者的无进展生存期和总生存期(原文中相关表格,如 Table 1,展示这些 bsAbs 在血液系统恶性肿瘤治疗中的关键数据,包括批准时间、适应症、临床试验结果等,让读者更直观地了解其疗效)。
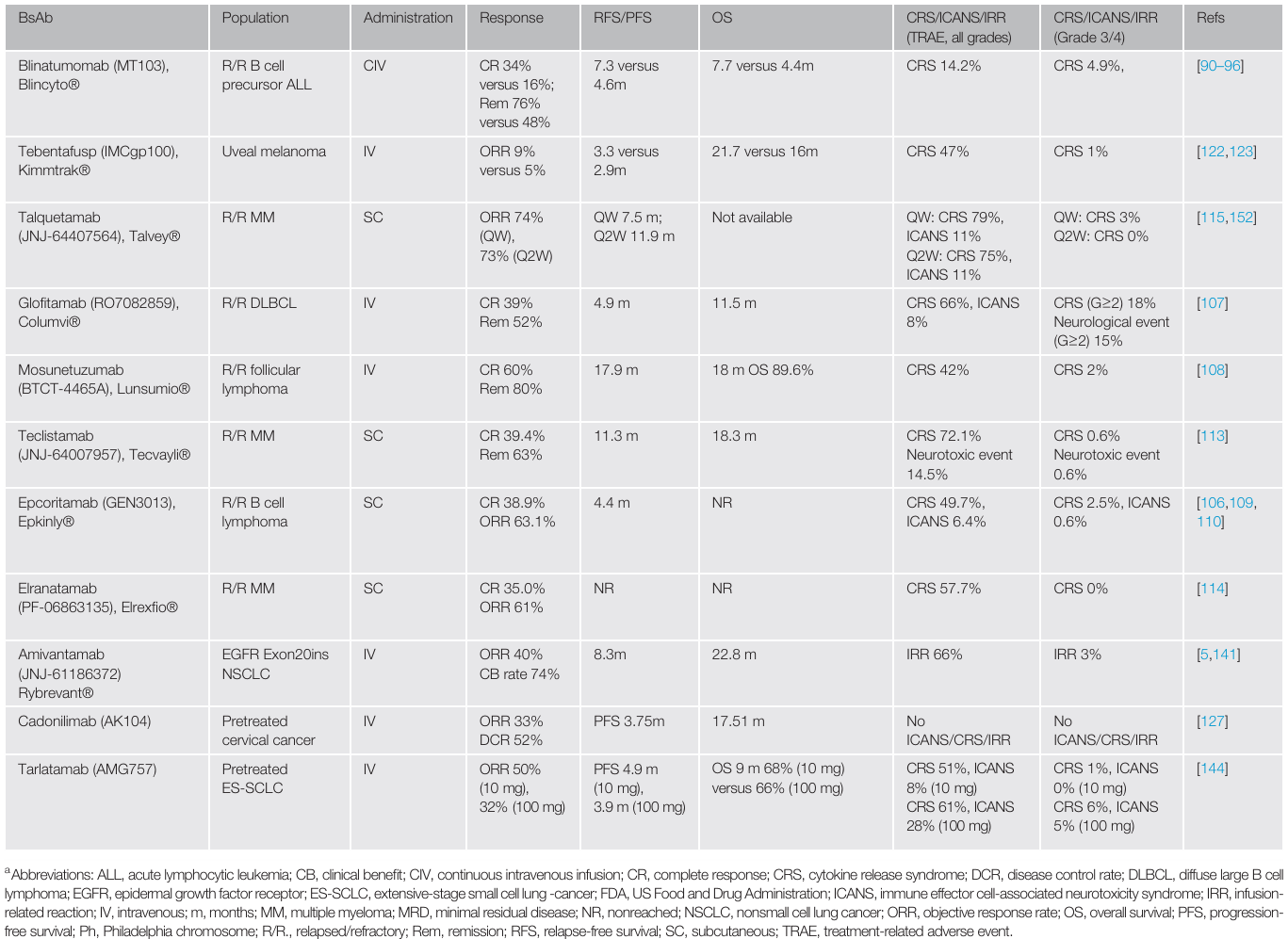
实体肿瘤:尽管在实体肿瘤的治疗中,bsAbs 面临着更多挑战,但也取得了一些突破 。tebentafusp 是一种针对葡萄膜黑色素瘤的 ImmTAC 分子,它的出现为这种对传统免疫治疗耐药的肿瘤提供了新的治疗选择,显著延长了患者的总生存期 。amivantamab 获批用于治疗 EGFRex20ins 非小细胞肺癌,tarlatamab 则被批准用于治疗复发 / 难治性广泛期小细胞肺癌,它们在临床试验中都展现出了一定的疗效 。此外,还有许多针对不同实体肿瘤抗原的 bsAbs 正在研发中,如针对 HER2、CLDN18.2 等抗原的药物,为未来实体肿瘤的治疗带来了新的希望 。
五、双特异性抗体面临的挑战与应对策略
毒性反应:细胞因子释放综合征(CRS)是 bsAbs 治疗中常见的不良反应,它是由于免疫细胞过度激活,导致促炎细胞因子大量释放引起的 。症状轻重不一,严重时可能危及生命 。目前,临床上主要通过密切监测、支持治疗和使用抗炎药物(如 tocilizumab)来管理 CRS 。免疫效应细胞相关神经毒性综合征(ICANS)也是一种严重的神经系统毒性,其发病机制与免疫细胞激活和细胞因子释放有关,症状包括震颤、失语等,严重时可进展为谵妄、癫痫甚至昏迷。ICANS 的管理主要依靠密切监测和支持治疗,皮质类固醇激素是常用的治疗药物 。输液相关反应(IRRs)通常在输液过程中或输液后短时间内出现,症状多样,可轻可重 。通过调整输液速度、预先使用药物(如抗组胺药、类固醇等)等方法可以减少 IRRs 的发生 。此外,使用 bsAbs 治疗还可能增加机会性感染的风险,尤其是在血液系统恶性肿瘤患者中,这与患者自身免疫状态、bsAbs 的 “脱靶” 效应以及联合治疗等因素有关,需要加强监测和预防。
耐药机制:目前对 bsAbs 耐药机制的了解主要来自 TCEs 相关研究。免疫检查点蛋白的上调是潜在的耐药机制之一,例如在急性髓系白血病(AML)细胞系中,PD - L1 和 PD - L2 的表达上调会降低 AMG 330 的细胞毒性 。肿瘤细胞表面靶抗原表达的下调或丢失也会导致耐药,如部分接受 blinatumomab 治疗的患者会出现 CD19 表达缺失 。此外,MHC - I 下调或 IFN - γ 信号通路受损也可能与耐药有关 。同时,机体产生的抗药物抗体(ADAs)会与 bsAbs 结合,影响其疗效,甚至可能引发严重的不良反应 。
应对策略:为了应对这些挑战,研究人员在不断探索新的方法 。在优化 bsAbs 设计方面,通过创新的工程技术,如开发多特异性抗体、引入新的抗原靶点等,可以提高 bsAbs 的疗效和特异性,减少 “脱靶” 毒性 。在联合治疗策略上,将 bsAbs 与化疗、抗体 - 药物偶联物(ADCs)等联合使用,有望发挥协同作用,克服耐药性 。此外,利用计算和人工智能技术辅助 bsAbs 的研发,可以加速新型 bsAbs 的开发和临床应用。
六、总结与展望
双特异性抗体在癌症治疗领域展现出了巨大的潜力,尤其是在血液系统恶性肿瘤的治疗中取得了显著的成效 。然而,在实体肿瘤治疗方面仍面临诸多挑战,如抗原表达异质性、肿瘤微环境的免疫抑制等 。未来,需要进一步优化 bsAbs 的设计和生产工艺,深入了解其作用机制和耐药机制,探索更有效的联合治疗方案 。同时,利用先进的技术手段,如计算和人工智能技术,将有助于加速 bsAbs 的研发和临床应用,为癌症患者带来更多的治疗选择和更好的治疗效果 。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57