摘要:高浓度蛋白质溶液在生物制药中应用广泛,其制备方法通常在早期研发阶段采用旋转柱浓缩(SCC),后期采用切向流过滤(TFF) 。本研究以一种 Fc 融合蛋白为例,发现两种方法制备的高浓度溶液在储存稳定性上存在差异 。TFF 处理的样品在储存时聚集和粘度增加更明显,这是由于 TFF 过程中在中间不稳定缓冲条件下的剪切作用,导致蛋白质构象改变 。因此,早期研发阶段测试 TFF 过程中过渡缓冲状态下的剪切应力敏感性,对降低产品不稳定风险十分重要 。
一、高浓度蛋白质溶液的制备与稳定性问题
在生物制药领域,为满足患者需求并降低成本,高浓度蛋白质制剂备受青睐,尤其是用于皮下注射的高剂量蛋白质治疗药物 。不过,开发这类制剂面临诸多挑战,其中溶液粘度增加和蛋白质聚集倾向是较为突出的问题 。在药物研发过程中,早期由于蛋白质样品量有限,常采用 SCC 方法进行缓冲液交换和浓缩;后期随着蛋白质产量增加,则会使用 TFF 方法 。通常认为这两种方法制备的蛋白质性质相似,但本研究发现,对于一种 Fc 融合蛋白,SCC 和 TFF 制备的高浓度溶液在储存稳定性上存在显著差异 。这种差异表明,缓冲液交换路径可能对蛋白质的储存稳定性和粘度产生重要影响 。
二、实验方法
蛋白质的制备与处理:首先通过模型细胞系生产 Fc 融合蛋白,经 Protein A 捕获和离子交换色谱法纯化后得到未配方的 bulk drug substance(UFBDS) 。对部分 UFBDS 添加聚山梨酯 80(PS80)得到配方的 bulk drug substance(FBDS) 。然后分别用 SCC 和 TFF 两种方法将蛋白质溶液浓缩至目标浓度 。SCC 是利用离心过滤装置将 UFBDS 浓缩,TFF 则是使用特定的膜系统在一定压力和通量条件下进行缓冲液交换和浓缩(可简单绘制 SCC 和 TFF 过程的示意图,帮助读者理解两种方法的操作流程) 。
分析方法:运用多种分析技术对样品进行检测 。采用尺寸排阻色谱(SEC)监测蛋白质聚集情况,通过动态光散射(DLS)测量流体力学半径,用非还原毛细管电泳 - 十二烷基硫酸钠(CE - SDS)分析大小变体,使用 Malvern Viscosizer™ 200 测定粘度,利用差示扫描量热法(DSC)和差示扫描荧光法(DSF)研究蛋白质的热稳定性和构象变化 。此外,还通过组合筛选实验,研究不同缓冲条件和剪切应力对蛋白质聚集的影响 。
三、实验结果
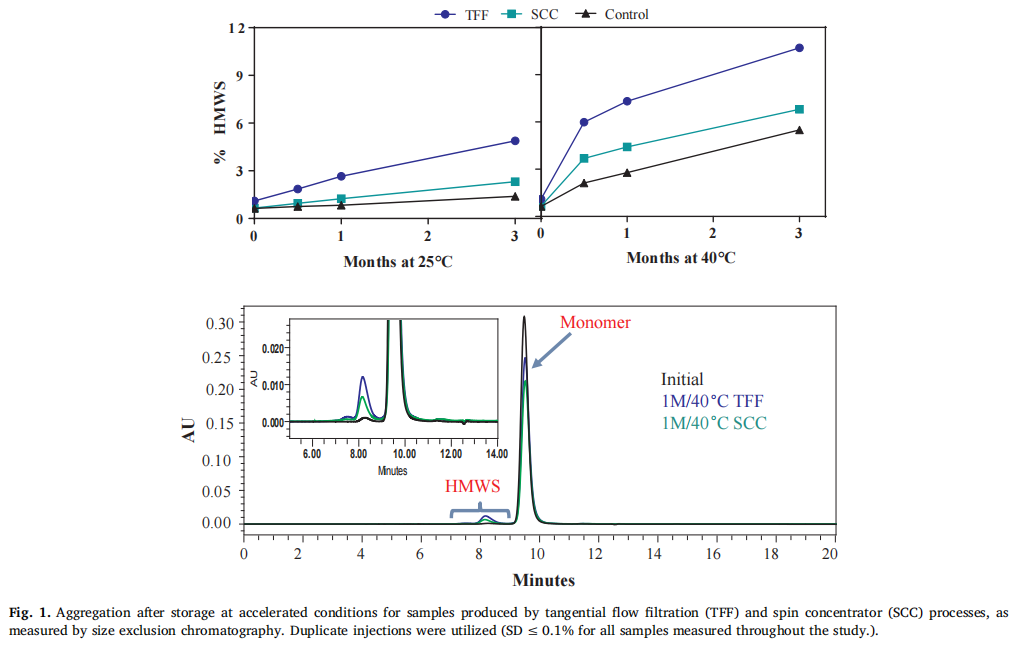
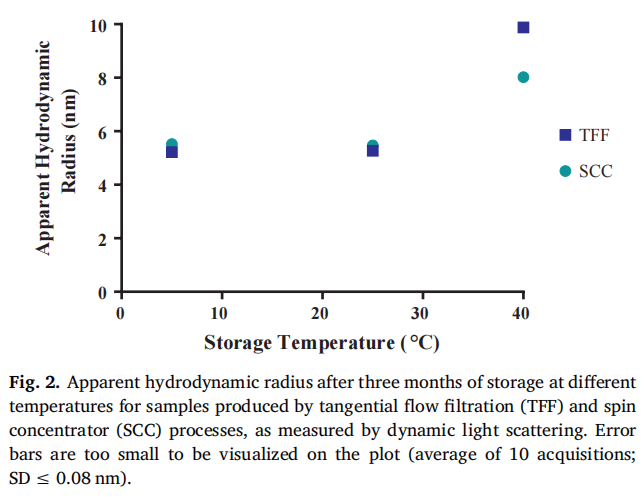
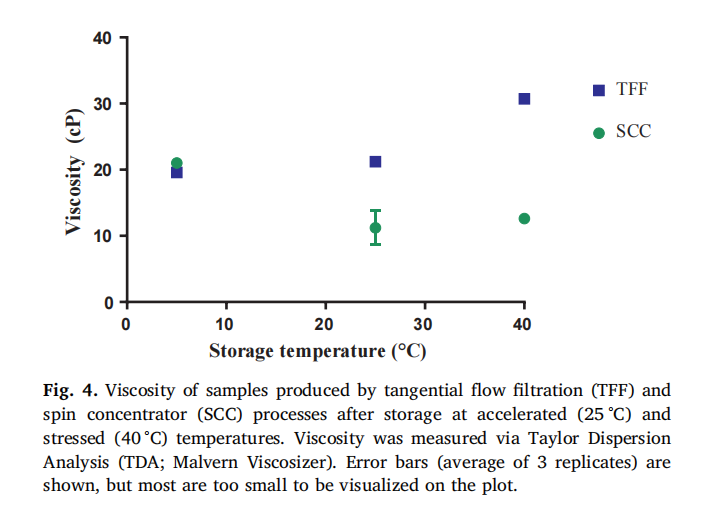
储存稳定性差异:在不同温度(5°C、25°C 和 40°C)下储存 3 个月后,TFF 处理的样品在聚集、流体力学半径、大小变体和粘度等方面均表现出比 SCC 处理样品更明显的变化 。例如,在 25°C 和 40°C 储存时,TFF 样品的聚集程度(以 % HMWS 表示)更高(原文 Fig. 1,直观展示 TFF 和 SCC 样品在加速储存条件下的聚集情况差异);40°C 储存 3 个月后,TFF 样品的流体力学半径更大(原文 Fig. 2,呈现不同处理样品在不同储存温度下的流体力学半径变化);在 CE - SDS 分析中,40°C 储存时 TFF 样品的降解片段浓度更高(原文 Fig. 3,展示 TFF 和 SCC 样品在 40°C 储存 3 个月后的大小变体差异);而且 TFF 样品的粘度在储存后显著增加,而 SCC 样品的粘度几乎不变(原文 Fig. 4,对比 TFF 和 SCC 样品在不同储存温度下的粘度变化) 。
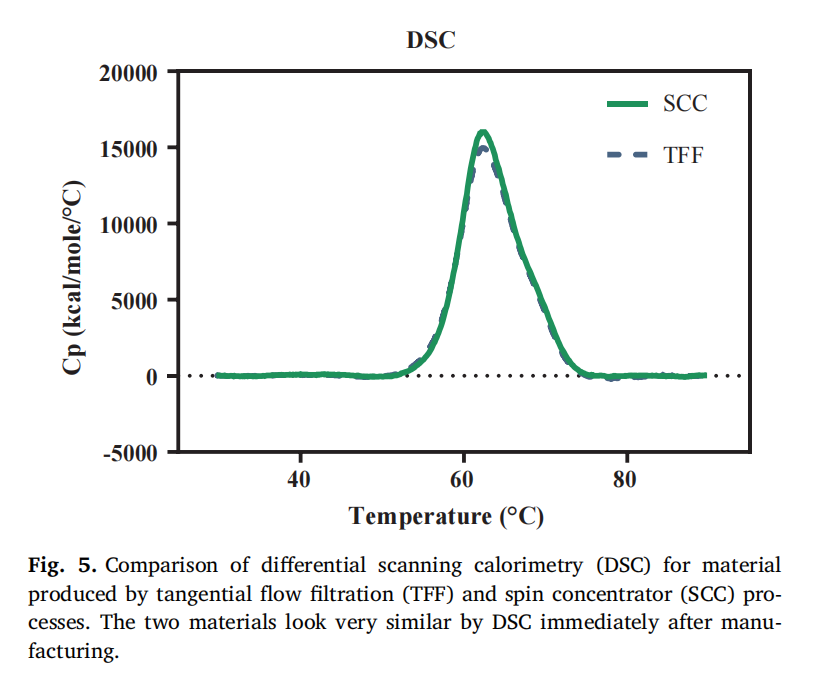
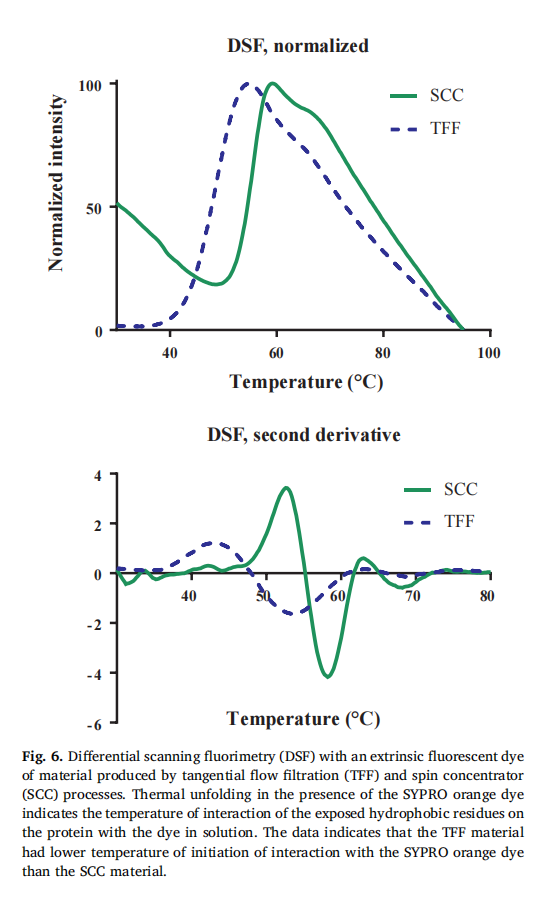
材料特性差异:尽管两种方法制备的蛋白质溶液在生产后立即进行的常规释放检测中表现相似,但 DSF 分析显示,TFF 处理的蛋白质在较低温度下就开始与荧光染料发生相互作用,表明其三级结构发生了变化,疏水性表面暴露更多,相比 SCC 处理的蛋白质更不稳定 。而 DSC 数据未显示出两者的差异(原文 Fig. 5 和 Fig. 6,对比 DSC 和 DSF 对 TFF 和 SCC 处理材料的分析结果) 。
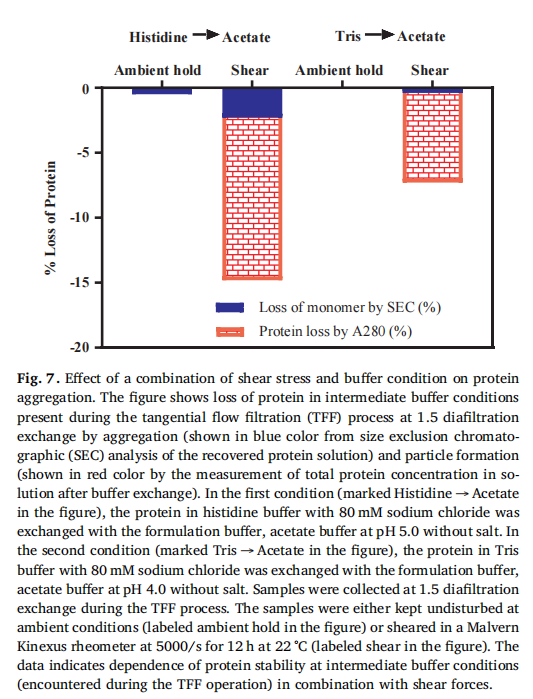
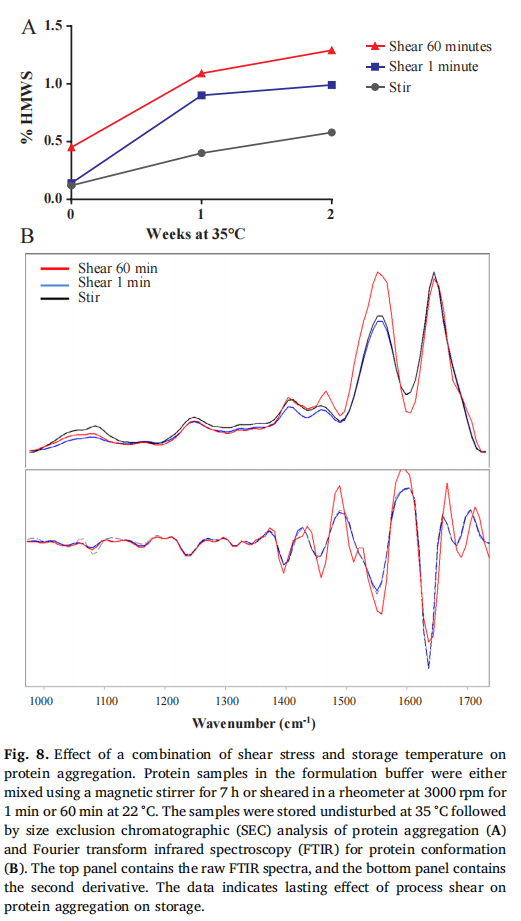
缓冲条件和剪切应力的影响:实验发现,在从一种缓冲液转换到另一种缓冲液的过程中,特别是在 0.5 - 1.5 倍透析体积的中间缓冲条件下,蛋白质稳定性较差。当样品处于这种中间缓冲条件并受到剪切应力时,蛋白质损失和聚集现象更为严重(原文 Fig. 7,展示不同缓冲条件和剪切应力组合下蛋白质的损失情况)。进一步研究发现,对较低浓度的蛋白质样品施加不同程度的剪切应力,并在 35°C 储存后,样品的聚集程度与剪切暴露相关,且蛋白质构象也发生了变化,这通过 FTIR 光谱分析得到了证实(原文 Fig. 8,呈现剪切应力和储存温度对蛋白质聚集和构象的影响)。
四、结果讨论
两种制备方法的差异:在药物研发早期,SCC 常被用作 TFF 的替代方法,但本研究表明二者存在差异 。TFF 处理的蛋白质在储存时更易聚集,粘度也更高,这可能是因为 TFF 过程中蛋白质在中间不稳定缓冲条件下受到剪切,导致构象发生变化 。虽然 DSC 显示两种方法处理的蛋白质解折叠温度相似,但 DSF 结果表明 TFF 处理的蛋白质在较低温度下就会暴露更多疏水区域,说明其构象稳定性较差 。
缓冲条件和剪切应力的作用:蛋白质的构象由非共价力维持,在 TFF 过程中,随着蛋白质浓度增加,溶液粘度和维持通量所需的压力也会增加,再加上透析过程中复杂的缓冲环境,容易破坏蛋白质的构象稳定性 。从纯化缓冲液到配方缓冲液的交换过程中,中间缓冲状态可能使蛋白质形成部分解折叠的中间体,若这些中间体保留在最终产品中,会影响蛋白质的稳定性 。此外,剪切应力本身虽不一定会导致蛋白质显著聚集或降解,但在不稳定的缓冲环境下,会加剧蛋白质的聚集 。
对药物研发的启示:了解蛋白质对缓冲条件和剪切应力的敏感性,对开发稳定的药物制剂至关重要 。早期研究中使用 SCC 方法可能无法发现蛋白质对特定缓冲环境的不稳定性,而在后期 TFF 过程中这种问题可能会显现出来 。因此,在早期研发阶段就应测试蛋白质在 TFF 过程中过渡缓冲状态下的剪切应力敏感性,以避免在药物开发后期出现意外问题 。
五、研究结论
本研究通过对 Fc 融合蛋白的研究发现,TFF 和 SCC 制备的高浓度蛋白质溶液在储存稳定性上存在差异,TFF 过程中在中间不稳定缓冲条件下的剪切作用会导致蛋白质构象改变,进而使 TFF 处理的材料在储存时聚集速率和粘度更高 。对于对缓冲条件敏感的蛋白质,早期研究其在剪切应力下对缓冲液交换环境的敏感性,有助于开发更稳健的配方和工艺,避免药物开发后期出现产品稳定性问题 。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57