自1922年胰岛素用于治疗糖尿病,肽类药物正式登上医学舞台。发展至今,全球已有近100种肽类药物获批。据弗若斯特沙利文数据预测,到2030年,全球多肽药物市场规模将达到2108亿美元,其中中国市场规模占全球比重维持在15%左右。多肽药物市场中,糖尿病、肿瘤和罕见病是拉动多肽药物市场扩容的“三驾马车”。2025年,以下6款创新多肽药物有望首次获批。
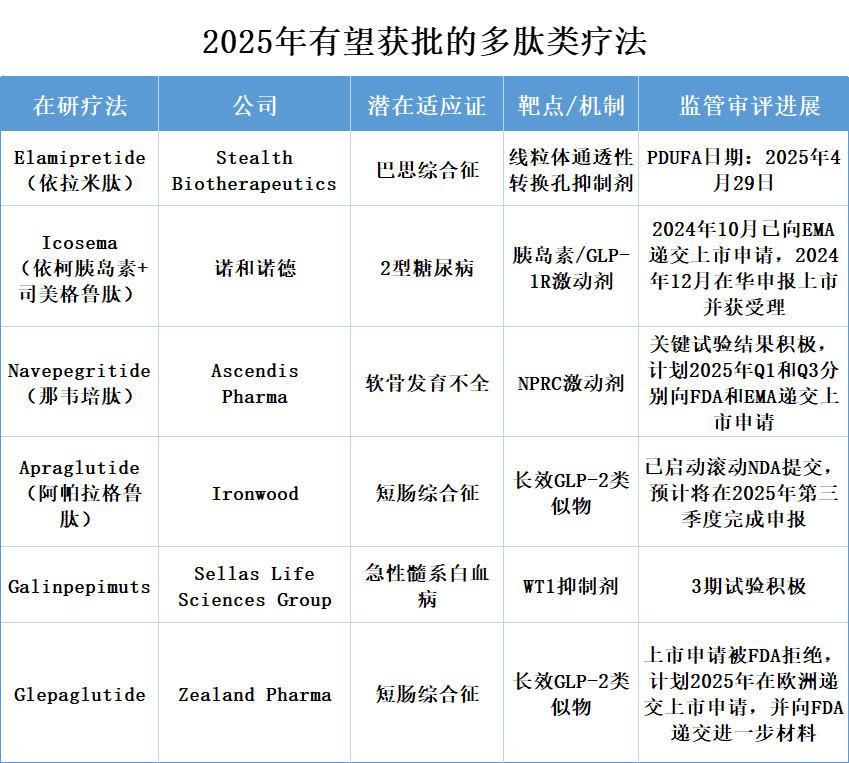
1、Elamipretide
Elamipretide(依拉米肽)是一种肽化合物,可轻易穿透细胞膜,靶向线粒体内膜,并可逆性地与心磷脂(cardiolipin)结合。在临床前或临床研究中观察到该疗法可增加线粒体呼吸作用、改善电子递送链功能和ATP生成,并减少致病性活性氧(ROS)的形成。这种elamipretide-心磷脂结合已被证明可以使线粒体内膜结构正常化,从而改善线粒体功能。
Elamipretide已获得美国FDA授予孤儿药资格、快速通道资格和罕见儿科疾病认定,以及欧洲药品管理局(EMA)的孤儿药资格,用于治疗巴思综合征——一种由tafazzin基因突变引起的疾病,该突变导致心磷脂水平降低,心磷脂是一种在线粒体功能中起主要作用的磷脂。这种疾病的特征是心脏异常、肌肉无力、反复感染和生长迟缓。
1月23日,Stealth BioTherapeutics宣布,美国食品药品监督管理局(FDA)延长了用于治疗巴思综合征的Elamipretide新药申请(NDA)的审查期。NDA提交的包括来自2/3期TAZPOWER研究和3期SPIBA-001自然史对照研究的数据。FDA需要更多时间审查补充信息,其认为这一信息是对申请的重大修改。目前,新的处方药使用者费用法案的目标日期(PDUFA日期)是2025年4月29日。据悉,若是该药成功获批上市,将成为首个FDA批准的巴思综合征治疗药物。
2、Icosema
IcoSema是诺和诺德研发的复方制品,由每周一次依柯胰岛素和每周一次司美格鲁肽(semaglutide)的固定比例组合。其中,依柯胰岛素是人胰岛素类似物,其氨基酸结构有三处进行了替换,并附加了C20二十烷脂肪二酸链,使该分子能够可逆地与白蛋白结合,从而将半衰期延长至196小时(约7天),并在经过3-4次每周一次注射后达到稳定状态。该疗法被设计为一周一次皮下注射使用。依柯胰岛素已在欧盟、加拿大、澳大利亚和日本以Awiqli为商品名获得批准。司美格鲁肽则是一种胰高糖素样肽-1(GLP-1)类似物,它通过突破性的肽链结构优化,使得分子半衰期延长至7天,实现了一周一次给药且血药浓度非常平稳。
目前,诺和诺德已基于IcoSema针对2型糖尿病的COMBINE系列III期研究在欧盟提交其上市申请。其中COMBINE 1研究和COMBINE 3研究的结果已公开。随后,该药又于2024年12月在华申报上市并获受理。
据悉,在COMBINE 3研究中,IcoSema取得了非劣效于甘精胰岛素U100和门冬胰岛素的结果。在总体基线HbA1c为8.30%的情况下,IcoSema组HbA1c降幅为-1.47%,而甘精胰岛素U100和门冬胰岛素组HbA1c降幅为-1.40(估计治疗差异:-0.06%)。此外,在基线体重为85.8kg的基础上,接受IcoSema治疗的患者体重显著减轻,IcoSema组体重减轻了3.6kg,而甘精胰岛素U100和门冬胰岛素组体重增加了3.2kg(估计治疗差异:-6.7kg)。
3、Navepegritide
Navepegritide(TransCon CNP,那韦培肽)属于一款长效的C 型利钠肽前药,被用于软骨发育不全的治疗。软骨发育不全属于人类最为常见的矮小症,是由编码成纤维细胞生长因子受体3(FGFR3)基因当中的一种常见致病突变所引发,这种突变会给骨骼生长的软骨内骨化过程带来影响。针对软骨发育不全发病机制的治疗手段始终是一项重大却尚未被满足的需求。
据Ascendis Pharma在JPM 2025大会上透露,Navepegritide用于治疗软骨发育不全的疗法,计划在2025年第一季度向FDA提交新药申请(NDA),并在2025年第三季度向欧洲药品管理局(EMA)提交市场授权申请。在关键的ApproaCH试验中,Navepegritide显著改善了腿部弯曲,这是一种常见的并发症,而安慰剂组则观察到恶化。计划在2025年第四季度提交治疗低磷酸酯酶血症的临床试验申请(IND)。目前,此药已同时被FDA和EMA认定为孤儿药。
4、Apraglutide
Apraglutide(阿帕拉格鲁肽)是Ironwood Pharmaceuticals公司通过收购VectivBio公司获得的一种新一代、人工合成的长效GLP-2类似物,拟开发用于一系列GLP-2在疾病病理生理学中可以发挥中心作用的罕见胃肠疾病。目前,该药治疗短肠综合征(SBS)的临床试验也已进入3期阶段;治疗胃肠道急性移植物抗宿主病的临床试验已进入2期阶段。
Ironwood正在III 期STARS试验中测试Apraglutide,该试验于2024年2月显示,SBS患者对肠外支持的需求减少了25%,而安慰剂患者则减少了12%。Apraglutide也达到了其次要终点,包括能够至少停止肠外支持一天的患者比例增加。
2025年1月,Ironwood宣布了一项大幅裁员计划,以投入更多资源推动其先导分子Apraglutide通过III期试验和滚动NDA提交。Ironwood还展示了来自STARS开放标签扩展研究的额外数据,显示更多患者因长期暴露Apraglutide而退出肠外支持。据悉,Ironwood已启动Apraglutide的滚动NDA提交,预计将在今年第三季度完成申报。
5、Galinpepimut-S
Galinpepimut-S(GPS)是一种多肽候选药物,已被改良以增强针对WT1蛋白的免疫反应的程度和持续时间。WT1蛋白是在多种癌症类型中过度表达的蛋白。在构成GPS的多肽混合物中,四种多肽中的两种多肽在单个氨基酸残基上经过刻意突变。这些突变肽被免疫系统识别为非自身产物,因此不易引发免疫耐受。这些突变肽通过人工智能(AI)设计,用于诱导针对癌细胞中突变肽和自然存在肽的强力T细胞反应,达到杀伤过度表达WT1蛋白的肿瘤细胞的效果。
2025年1月,SELLAS Life Sciences Group(SELLAS)公司宣布,独立数据监测委员会(IDMC)已完成关键性3期临床试验REGAL的预定中期分析。该试验评估了在研多肽免疫疗法Galinpepimut-S(GPS)治疗急性髓系白血病(AML)的疗效和安全性。分析结果显示,试验参与者的中位总生存期超过12个月,而类似患者群体的预期生存期约为6个月。IDMC对中期数据的审查支持试验按照原始方案继续进行。
REGAL是一项开放标签注册性3期临床试验,招募通过二线挽救治疗达到完全缓解(CR2)的AML患者。该试验的主要终点为总生存期。目前试验尚未揭盲,然而部分盲态数据已显示,在入组完成约10个月后,确认死亡的患者少于一半,且中位随访时间约为13.5个月(范围为1个月至超过3年)。这一结果表明中位生存期超过12个月,而类似患者群体的预期生存期约为6个月。此外,对接受GPS治疗的随机选取患者样本的早期免疫反应进行的盲态分析显示,80%的患者产生了特异性免疫反应。
这些数据与GPS先前的试验结果一致。在2期临床试验中,接受GPS治疗的患者的中位总生存期为21个月,而接受标准治疗的患者仅为5.4个月,GPS组患者的特异性免疫反应率为64%。
6、Glepaglutide
Glepaglutide为一款潜在治疗SBS的长效GLP-2类似物液体制剂,并将配备可皮下注射的自动给药装置,旨在降低或消除SBS患者的肠外营养支持,FDA曾授予孤儿药资格。
2024年12月,Zealand Pharma A/S宣布收到了FDA对Glepaglutide治疗SBS的新药上市申请(NDA)发出完整回复函(CRL),FDA的CRL中要求增加临床试验以提供Glepaglutide的拟上市剂量规格更多的有效性和安全性证据。Zealand Pharma A/S在表达失望之余,同时表示将与FDA进一步沟通,并在2025年启动一项III期临床研究以支持美国和欧盟的上市需要。
根据Zealand Pharma的说法,向FDA提交申请是基于一项名为EASE-1(NCT03690206)的安慰剂对照的3期注册试验结果。该试验确实达到了其主要终点,即在24周时,与基线相比,每周两次的格列帕肽剂量使每周肠外支持量在统计学上显著减少了5.13升。然而,每周一次的glepaglutide却并没有达到统计学意义上的显著差异。(安慰剂2.85L vs 每周一次3.13L )另外一个问题则出在第二个主要终点——临床响应率上,在Glepaglutide组中,有66%的患者出现具有临床意义的改善,对照组的临床响应率是38.9%。
参考资料:
[1] 2024年多肽药物行业进展. 知识药点. 2025-02-05.
[2] 肽类药物:现状、进展与未来展望. 生物制品圈. 2025-03-07.
[3] 多肽专栏 | 多肽药物研发和市场格局分析与展望. 中生药协. 2025-03-13.
[4] 2025年4月,3款罕见病药有望在美国获批. 罕见病信息网. 2025-04-03.
[5] FDA延长对Elamipretide治疗Barth综合征的审查. 香港济民药业. 2025-01-24.
[6] 1月3款创新药有望获FDA批准. 药明康德. 2025-01-02.
[7] Tides 速递 | 诺和诺德「依柯胰岛素司美格鲁肽复方」在华申报上市. 多肽圈. 2024-12-09.
[8] 罕见病ACH“救命药”关键实验达主要终点,每年长高6厘米!. CPHI制药在线. 2024-10-24.
[9] JPM 2025 Ascendis. 药政时势. 2025-01-15.
[10] 同源不同命!作为GLP-1的“姐妹”,它却被开发治疗这些疾病. 医药观澜. 2024-07-05.
[11] Ironwood裁员50%. 药物探索. 2025年01月31日.
[12] 癌症患者总生存期延长一倍!多肽免疫疗法关键性3期临床试验中期结果积极. 药明康德. 2025年01月24日.
[13] 临床证据不足!短肠综合征长效GLP-2类似物上市被拒. 药讯随说. 2024年12月20日.
[14] FDA拒批长效GLP-2. 佰傲谷BioValley. 2024年12月20日.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57