美国作为全球最大的医药市场,其仿制药行业发展成熟,有着完善的政策法规和高度竞争的市场环境。而中国的仿制药市场近年来也在快速发展,政策不断完善,产业结构逐步优化。
一、中美仿制药行业对比
(一)批文数量(申请号数量)分布与集中度对比
药智数据显示,美国约880家化学仿制药企业中,化学仿制药申请号数量TOP10企业(梯瓦、Hikma Pharmaceuticals plc、CHARTWELL、Amneal Pharmaceuticals Inc、辉瑞、太阳制药、阿拉宾度、山德士、晖致、ZYDUS)占据超32%批准的仿制药申请号(数据截至2025年4月15日,以母子公司进行统计),头部效应明显;72%的仿制药企的申请号数量不足10个。
表1 美国化学仿制药申请号数量TOP10企业
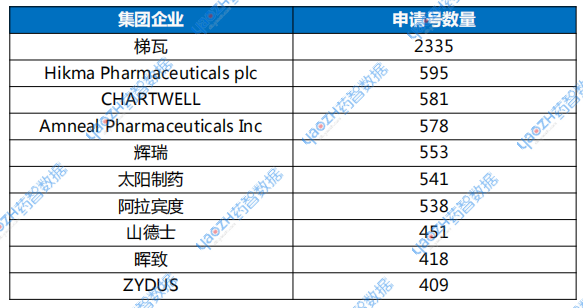
数据来源:药智数据
中国约3500家化学仿制药企业中,化学仿制药批文拥有数量TOP10企业(华润双鹤、上海医药、科伦药业、上海现代制药、复星医药、哈药集团、白云山医药、石药集团、辅仁药业、倍特药业)占据11%批文总数量(数据截至2025年4月15日,以母子公司进行统计),相对美国来说,整体均匀分布,但仍有39%的企业化学仿制药批文数量仅1-2个。
表2 中国化学仿制药批文拥有数量TOP10企业
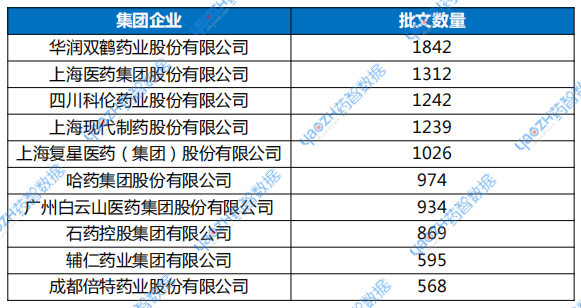
数据来源:药智数据
美国市场高度集中,梯瓦等巨头通过并购整合持续扩大优势。大企业凭借研发、生产、渠道一体化,主导高难度仿制药市场(如复杂注射剂、缓控释制剂)。
中国市场分散竞争,中小型企业占比较大,同质化严重,依赖低端品种(如普通片剂)。集采倒逼集中度提升,2023年化药集采中,前10大企业中标份额占比升至35%,小企业加速出清。
(二)行业发展环境对比
从政策法规角度来看,美国拥有完善且成熟的政策法规体系,为仿制药行业的发展提供了坚实的保障。1984年颁布的《药品价格竞争和专利期恢复法》(Hatch-Waxman法案),建立了简化药品申请程序的制度,大幅缩短了仿制药的审批时间,降低了研发成本,促进了仿制药的快速上市。该法案还规定了专利链接制度和市场独占期制度,在保护原研药企业专利权益的同时,也给予了仿制药企业一定的市场激励。相比之下,我国近年来也在不断完善仿制药政策法规,出台了一系列鼓励仿制药发展的政策措施,如仿制药一致性评价政策、优先审评审批制度等,旨在提高仿制药质量,促进仿制药产业升级。
医保政策对仿制药行业的发展也有着重要影响。美国的医保体系较为复杂,包括公立医保和私立医保。医保机构通过与药企谈判、集中采购等方式,对药品价格进行控制,这在一定程度上促进了仿制药的使用。仿制药凭借其价格优势,在医保报销中占据了较大的比例。我国的医保政策同样致力于提高药品的可及性和降低医疗费用,通过医保目录调整、医保支付方式改革等措施,引导患者使用质优价廉的仿制药。医保部门对通过一致性评价的仿制药给予优先纳入医保目录、提高报销比例等政策支持,进一步推动了仿制药的市场推广。
在市场竞争环境方面,美国仿制药市场竞争激烈,但竞争秩序相对规范。企业之间主要通过技术创新、产品质量和价格优势来争夺市场份额。由于市场集中度较高,大型仿制药企业在市场竞争中具有较强的话语权。而我国仿制药市场竞争也异常激烈,企业数量众多导致市场竞争较为分散。但随着我国医药行业的规范发展和市场监管的加强,市场竞争环境正在逐步改善,企业越来越注重产品质量和创新能力的提升。
(三)质量与监管体系对比
在质量标准方面,美国FDA制定了严格的仿制药质量标准,要求仿制药必须与原研药在活性成分、剂型、规格、给药途径和治疗作用等方面保持一致,同时对药品的杂质、溶出度、生物利用度等关键质量属性也有着严格地把控。FDA还定期对仿制药生产企业进行现场检查,确保企业的生产过程符合药品生产质量管理规范(GMP)要求。我国仿制药质量标准也在不断向国际标准靠拢,通过一致性评价工作,要求仿制药在质量和疗效上与原研药达到一致的标准。国家药品监督管理局加强了对仿制药生产企业的监管力度,提高了对药品质量的要求,确保患者能够用上安全有效的仿制药。
在一致性评价要求上,中美两国均对仿制药的生物等效性研究提出了严格标准。通过科学实验验证仿制药与原研药在质量、疗效和安全性上的一致性,确保患者用药的可及性和可靠性。在监管机构与力度上,美国FDA作为全球最 具权威性的药品监管机构之一,拥有专业的审评团队和严格的审评流程,对仿制药的研发、生产、销售等各个环节进行全面监管。一旦发现企业存在违规行为,FDA将采取严厉的处罚措施。我国NMPA在仿制药监管方面也发挥着重要作用,通过加强审评审批能力建设、完善监管制度等措施,不断提高仿制药监管水平。近年来,NMPA加大了对仿制药企业的飞行检查力度,对违规企业进行严肃处理,有力地保障了仿制药的质量安全。
二、国内仿制药企的破局之法
面对集采政策带来的挑战,国内仿制药企业需要积极采取应对策略,以适应市场变化,实现可持续发展。
成本控制是关键。企业可以通过优化生产流程,引入先进的生产技术和设备,提高生产效率,降低生产成本。通过与供应商建立长期稳定的合作关系,优化供应链管理,降低原材料采购成本。
质量提升不容忽视。企业要严格按照药品生产质量管理规范(GMP)要求,加强质量管理,确保仿制药与原研药在质量和疗效上一致。加大研发投入,开展仿制药一致性评价工作,提高产品的质量。创新研发是企业发展的动力源泉。
仿制药企业应积极向创新药领域转型,加大研发投入,开展创新药物研发。也可以在仿制药的基础上进行改良创新,开发新剂型、新复方制剂等,提高产品的附加值。
拓展市场也是企业应对集采的重要策略。企业可以积极开拓国际市场,通过国际认证,进入海外市场,分散市场风险。也可以加强在基层医疗市场的推广,扩大产品的覆盖范围。
随着集采政策的持续推进,市场竞争将更加激烈,一些实力较弱、产品质量不过关的企业将逐渐被淘汰,而大型企业凭借其规模优势、技术优势和品牌优势,将在市场竞争中占据主导地位,行业集中度将不断提高。创新转型将成为企业发展的必由之路。
在集采政策的倒逼下,仿制药企业将加大创新研发投入,向创新药领域转型,实现从仿制药为主向仿创结合的转变。企业将更加注重研发创新,开发具有自主知识产权的创新药物,提高产品的附加值和市场竞争力。
国际化发展将成为行业趋势。随着我国仿制药质量的不断提高,越来越多的企业将目光投向国际市场,通过国际认证,开展国际合作,将产品推向全球市场。国际化发展不仅可以扩大企业的市场空间,还可以提升企业的技术水平和管理能力,增强企业的国际竞争力。
三、结语
综上所述,中美仿制药行业在企业数量、批文数量(申请号数量)、发展环境、质量与监管体系等方面存在诸多差异。我国仿制药行业虽规模庞大,但在质量、研发投入等方面与美国仍有差距。集采政策的实施,为我国仿制药行业带来了挑战,也迎来了机遇。
参考来源:国家药监局、药智数据、中国医药工业信息中心、中国医药报、FDA



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57