2018年8月8日,国家局发布《关于征求境外已上市临床急需新药名单意见的通知》,遴选出了Alectinib Hydrochloride 等48个境外已上市临床急需新药名单,药品主要包括罕见病药物以及用于防治严重危及生命或严重影响生活质量的疾病药物,笔者在这里分析了名单所涉及的产品,并标出已经有同类国产品种的药物。初步数据显示,48款药物中诺华4款,吉利德和辉瑞分别是3款。
相关阅读:《外企红利!梳理分析CDE《关于征求境外已上市临床急需新药名单意见的通知》》
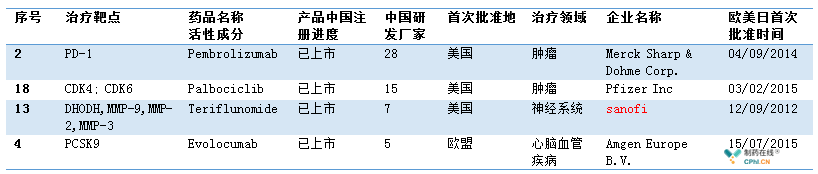
一.48款药物 4款药物已上市
笔者根据国家局发布的通知,分析目前CDE注册申报企业,根据公开资料,目前默沙东Pembrolizumab,辉瑞Palbociclib,赛诺菲Teriflunomide和安进Evolocumab已经获批上市,同时,有本土企业在这4个药物开发中,或是创新药,或是生物类似药/仿制药,均有布局,同时建议更有力支持本土企业的药物开发。
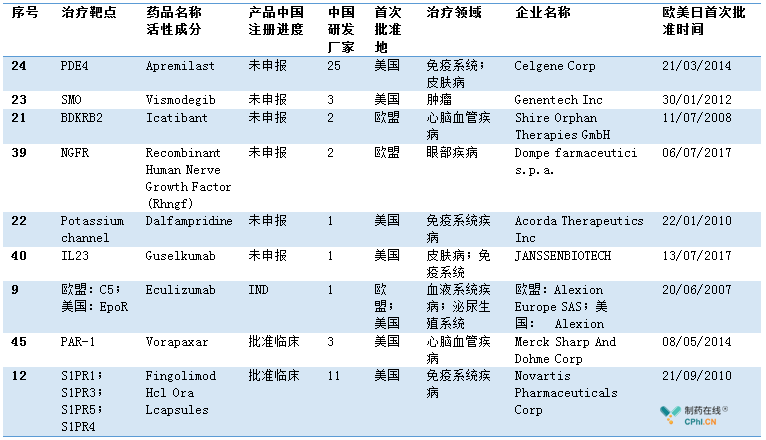
二.48款产品,9款产品需要重新评估
除了上文中已经提及的4款产品外,名单中有9款产品尚处于临床早期,并且已经有本土企业启动了仿制药/生物类似药的开发,个别药物本土厂家同样启动同靶点产品开发。建议国家局评估Apremilast ,Vismodegib ,Icatibant 等9款产品以及本土临床进展和注册进度,何不优先支持国内品种。
三.加速罕见病和重磅创新药物上市 上市后患者支付能力是一个很大障碍
48款药物中,下表所列药物处于临床各阶段,或是尚未在中国申报,表中多款罕见病和重磅创新药物将获审评审批优势。值得注意的是,那些名单中药物,1.企业应该提供欧盟,美国,日本批准上市的证明性文件,提供日本、中国香港、中国澳门、中国台湾等之一的上市文件;2.严格按照CTD格式提交文件;3.中国和亚裔人群与欧美人群疗效和安全性一致性评价,这一点很重要。但是如何证明没有人种差异,没有国际多中心数据的,安全性和一致性评价如何做呢?
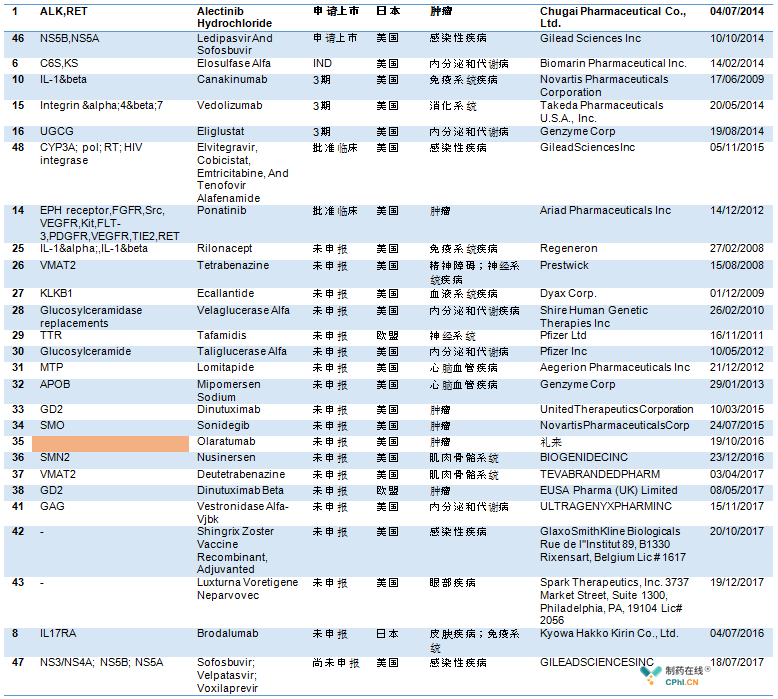
48款药物中,包括多款全球重磅药物,如Evolocumab,基因疗法Luxturna、PD-(L)1抗体keytruda、反义疗法Nusinersen,重磅抗病毒 药物Harvoni和Vosevi等。但是,这些重磅药物成本高昂,如基因疗法Luxturna每年定价85万美金,即便获批上市,如此高昂的定价,又有多少患者能够承担得起。
附表:名单中的几处错误
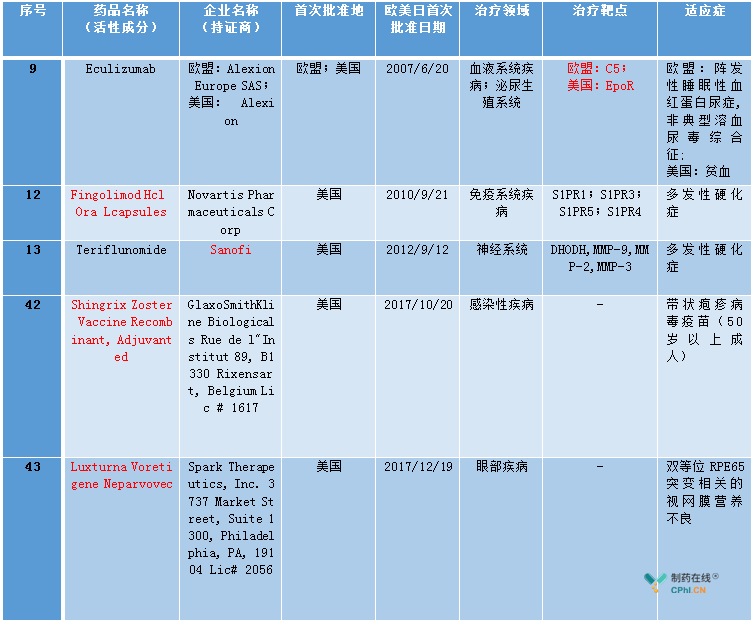
产品9: 治疗靶点,complement component 5
产品12: 活性成分中混入剂型
产品13: 企业名称为sanofi
产品42: 活性成分中混入商品名
产品43: 活性成分中混入商品名
除此外,个别公司名称书写上,不规范。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57