2018年8月8日,Paratek Pharmaceuticals宣布其新型抗生素Omadacycline获得FDA抗菌药物顾问委员会(ADAC)的高票支持,用于急性细菌性皮肤及皮肤组织感染(ABSSSI)以及社区获得性细菌性肺炎(CABP)的治疗,根据PDUFA日期Omadacycline将于今年10月初获得FDA批准上市。
Omadacycline是Paratek研发的一种新型的、口服或静脉注射(IV)的一天一次的四环素抗生素,对Gram阳性、Gram阴性和非典型细菌具有广谱活性。Omadacycline正在被开发作为社区获得性细菌感染的经验性治疗,包括ABSSSI、CABP、尿路感染及其他社区获得性感染。
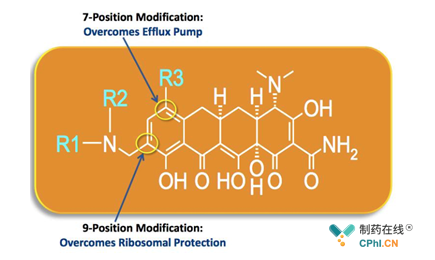
图1 Omadacycline(图片来源:Paratek官网)
目前抗生素在临床上应用中的问题就是耐药性,四环素抗生素也不例外,TetA外排泵(efflux pump)以及核糖体保护蛋白(Ribosomal protection proteins,RPPs)是四环素最为常见的两种耐药机制,Paratek通过对四环素类抗生素米诺环素(minocycline)进行化学基团的修饰(7/9)以克服四环素耐药机制,使Omadacycline对广泛的细菌表现出强劲的抑菌效果,如图1所示。
前期研发过程中,Omadacycline已在多项临床试验(Ph1×1,Ph2×1,Ph3×4)中进行了疗效以及安全性的研究,先后招募3315名患者,其中除去临床I期外其余临床研究均是以Linezolid或Moxifloxacin作为对照1∶1进行的研究。此外在其关键性的III期研究中均达到了主要和次要终点,在美国已经获得合格传染病产品(QIDP)认证和快速通道资格,Paratek也已于2018年第一季度向FDA递交了Omadacycline的NDA申请(209816和209817)。
近日,Omadacycline再次传出好消息。2018年8月8日,Paratek宣布Omadacycline获得FDA抗菌药物顾问委员会(ADAC)的高票支持,在ADAC进行会议讨论后,以17∶1的投票结果支持批准Omadacycline静脉注射剂(IV)和口服制剂用于ABSSSI的治疗,以及以14∶4的投票结果支持这以上两种剂型的药物用于CABP的治疗。根据PDUFA日期,FDA对Omadacycline治疗ABSSSI和CABP的决定将于2018年10月初揭晓,当然由于ADAC的高票支持,获批上市的可以说是板上钉钉的事。
ADAC的积极投票结果是基于3个III期临床研究的数据,ABSI-1108、ABSI-16301和CABP-1200,这3项研究入组了2150名患者,评估了每日一次口服制剂或静脉输注剂Omadacycline治疗ABSSSI和CABP的疗效及安全性。在这3项临床研究中,与对照组Linezolid或Moxifloxacin相比,Omadacycline均达到了FDA在修订意向治疗(mITT)人群(10%NI保守度,95%置信区间)中指定的统计学非劣性(NI)主要终点及次要终点,如表1所示。
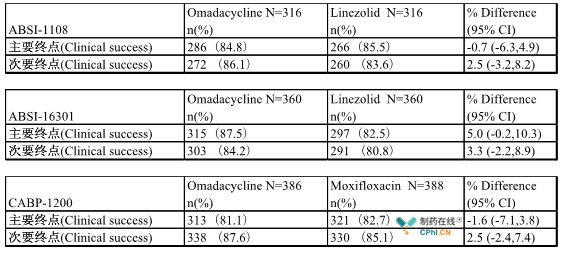
表1 ABSI-1108、ABSI-16301和CABP-1200临床试验结果
除去新药的疗法外,其安全性也是很重要的一方面。在一份报告中FDA审查员标出在CABP-1200临床试验中共有8名患者死亡,占比2.1%;对照Moxifloxacin组发生3例死亡,占比0.8%。在Omadacycline组8名死亡患者中,根据临床数据其中4名患者死于心血管,但FDA审查员认为Omadacycline没有造成患者心律不奇的风险,此外6名患者在临床试验中都有吸烟,因此这一临床上的安全事故对Omadacycline的上市并不会造成影响。
"Paratek研发的每日一次口服制剂或静脉输注剂处方药,Omadacycline可以使患者更早、更便利的在家中进行治疗,以及增加门诊治疗的安全性及有效性。" Paratek CEO Michael Bigham在声明中表示,"今天来自ADAC的推荐加速了Omadacycline的上市,这将会给患者和医生带来一种重要的新型治疗选择。"
参考来源:
1. FDA Advisory Committee Recommends Approval of Paratek's Omadacycline
2. Paratek's omadacycline sails through AdComm en route to October nod
3. FDA Briefing Document Meeting of the Antimicrobial Drugs Advisory Committee
作者简介:知行,生物化工硕士,从事细胞培养方面的研究。工作之余密切关注国内外医药行业动态以及研究进展,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57