自2016年3月,总局发布《国务院办公厅关于开展仿制药质量和疗效一致性评价的意见》,正式拉开仿制药一致性评价工作的序幕,意见要求289个基药目录品种,除需开展临床有效性试验和存在特殊情形外,应在2018年底前完成一致性评价,逾期未完成的,不予再注册。但理想很丰满,现实很骨感,在距离年底大限不足4个月的时间,回顾一致性评价的进度,似乎并不近乎人意,距离完成还有很大差距,整体进展可谓非常缓慢。
先人一步,14个品种率先通过一致性评价
2017年12月29日,第一批通过一致性评价品种出炉,截止目前,总局共先后发布了五批通过品种名单。在通过一致性评价的品种中,非289品种居多,289目录中仅有13个品种通过了一致性评价,其中苯磺酸氨氯地平片和蒙脱石散已分别有3家企业通过。
289目录中通过一致性评价的产品汇总
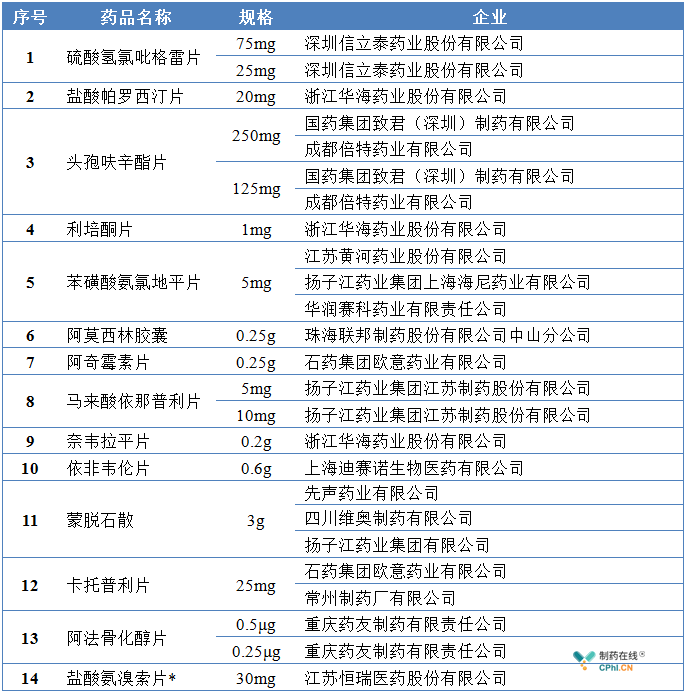
*信息来自江苏恒瑞医药股份有限公司公告
BE豁免,国内特有,企业利好享不停
2018年05月31日,总局发布《可豁免或简化人体生物等效性(BE)试验品种的公告》,提出了289目录中31个豁免BE品种和16个简化BE品种,无疑大大降低了这些品种的一致性评价的难度。政策虽好,但效果不好,截止目前,31个可豁免BE品种中,除了蒙脱石散已通过了一致性评价,9个品种已提出仿制药一致性评价补充申请外,其余21个品种至今无企业申报。
可豁免BE的品种企业申报情况汇总
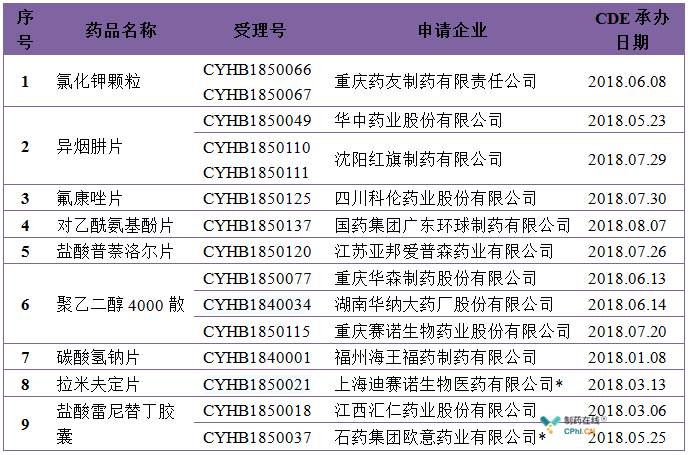
*完成BE后申报品种
此外,2018年07月30日,CDE发布《关于征求289基药目录中的国内特有品种评价建议的通知》 ,对289基药目录中的22个国内特有品种的一致性评价提出新要求,其中联苯双酯片、联苯双酯滴丸2个品种被建议放弃评价;14个品种免除临床有效性试验,其中5个品种可豁免BE;仅6个品种需要开展临床有效性试验,这与之前总局发布的《仿制药质量和疗效一致性评价品种分类指导意见》中提出国内特有品种需要的由企业重新开展临床试验证明其安全有效性的要求相比,对国内特有品种可谓是网开一面,大大降低评价难度。但目前仍无企业开展相关临床试验备案或BE备案,豁免BE品种也无企业提出一致性评价补充申请。
评价进度喜忧参半,未完成品种何去何从
从目前CDE仿制药补充申请收审情况看,除已获批的品种外,目前有34个289目录品种的补充申请在审评审批中;55个品种暂无申请但有BE备案;但仍有186个品种处于无通过、无BE备案、无申请的"三无"状态。
根据CDE仿制药一致性评价审评工作的安排,审评工作一般应当在受理后 120 日内完成,且发补时限不计入审评时限。基于此,是否可以猜测,已提交申请正在进行审评的品种,如果不发补或许能在大限之前通过一致性评价;对于目前暂未完成或启动BE试验的品种,基本可断定无法赶上2018年底的末班车了。但转念一想,如果严格按照之前设定的目标,这些没有通过一致性评价的289目录基药将在中国医药市场消失,不知针对目前的评价进度,国家有关部门是否会在后续提出相关的处置方案或延长评价时限。
已提交一致性评价补充申请但暂未获批的品种汇总
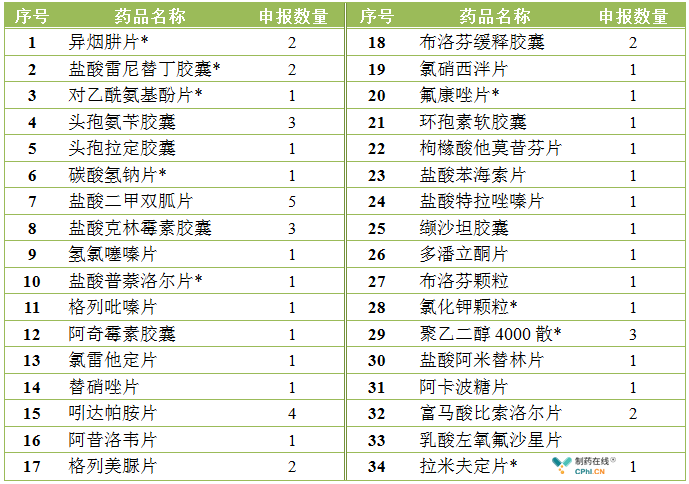
*为可豁免BE的品种
配套政策不断落地,评价工作仍龟速前进为哪般
自从开展仿制药一致性评价工作以来,CDE官网开辟了"仿制药一致性评价"专栏,并接连出台相关政策法规,指导企业一致性评价工作的顺利开展;此外,部分省和地方政府也相继出台奖励政策,对通过一致性评价的每个品种给予100-300万不等的资金支持来提高企业的积极性;同时,国家在药品采购方面也出台了相关的鼓励文件,在11个省市对通过一致性评价的品种如果在集中采购中没有入围,采取"直接挂网"的方式进入该省份医院端销售。
虽然配套政策不断落地,但企业对于289目录品种的一致性评价表现出不高的热情。目前的进程表明,这是在2018年底前不可能的任务,甚至多数是在2018年前还没有开始的任务,究其原因可能包括:
第一,高额的研发成本和BE试验投入与市场收入不对等。近日,刚通过盐酸氨溴索片一致性评价的江苏恒瑞在公告中披露,截止目前,公司在该项目上已投入研发费用约1004万人民币,而公司2017年该药品的销售额约为26.8万美元(约合人民币184.06万)。一致性评价高额的投入已然彰显,而289个品种均为基药,大多比较廉价,且一般不作为临床治疗的首选药物,药品的利润非常薄,10年甚至更长时间的利润都可能无法支持一致性评价的投入。大企业通过评估只会选择市场潜力大的产品进行研究,而小企业一般都望而止步。
第二,官方参比制剂未公布前企业不敢贸然进行研究。参比制剂的选取是仿制药一致性评价最关键的一环,自2017年03月17日总局发布首批仿制药参比制剂目录以来,截止2018年02月14日共发布了13批参比制剂目录,除国内特有品种,官方参比制剂几乎涵盖了289目录品种。企业为了避免总局发布的参比制剂与企业备案的有误,造成前期的研发费用打了水漂,在没有官方公布的参比制剂前迟迟不敢动手,加之BE试验需要排队,留给企业的时间已不多。
此外,参比制剂不易获得,药学一致性研究的挑战,临床试验机构资源不足及BE试验成功率低等种种原因,都导致了仿制药一致性评价进展缓慢。
参考来源:文中数据来源于CDE官网和药智网数据库。
作者简介:二小,药学硕士,医药行业从业者,从事进口药和新药注册工作,关注注册法规和新药动态。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57