2018年8月27日,Akcea Therapeutics反义核酸药物WAYLIVRATM (volanesorsen)的上市申请遭到FDA拒绝,FCS( 家族性乳糜微粒血症综合征)首款ASO药物上市之路遭遇挫折。这一结果,虽是意料之外,但是也在情理之中,血小板减少风险和不确定的收益/风险比是药物上市遭拒的重要原因。笔者在这里总结了药物的关键临床数据,但是,笔者依旧认为volanesorsen并非绝无上市的可能性,若公司所提出的血小板监测方案和剂量调整方案能够在临床试验中验证可行,volanesorsen必然会获批上市。
一、FDA发出CRL volanesorsen上市遇挫
2018年05月10日,专家委员会的投票结果12:8,整体看还是积极的,volanesorsen的临床收益是确定无疑的,但是血小板减少风险无疑引起巨大的争议。目前,volanesorsen已完成APPROACH和COMPASS临床试验,APPROACH OPEN LABEL临床试验尚未完成。这3项临床试验是支持药物上市申请的重要临床数据。
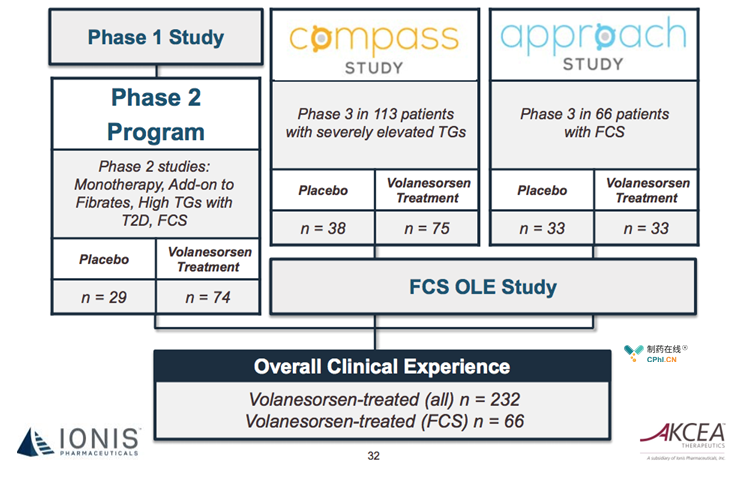
已有的临床数据能够证实药物确实能够明显降低患者TG水平
已有临床数据汇总:
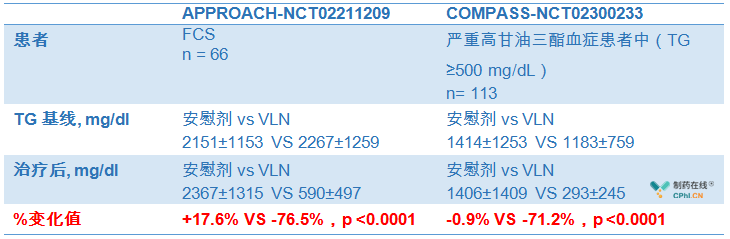
从已完成的两项临床研究中,300mg volanesorsen口服52周临床数据显示,相比安慰剂,volanesorsen能够明显降低FCS和严重高甘油三酯血症患者的TG水平,临床收益显著,p<0.0001。
volanesorsen的临床收益是确定无疑的。
二、volanesorsen收益风险比仍无定论 血小板减少饱受争议
上文中,APPROACH和COMPASS临床试验毫无疑问证实volanesorsen临床收益。
但是,临床试验中volanesorsen的血小板减少风险不容忽视。
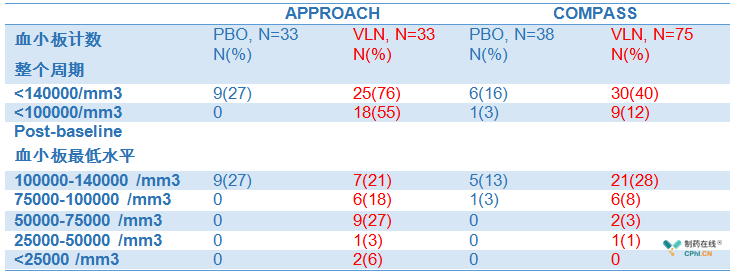
APPROACH和COMPASS临床试验中,能够看出,服用volanesorsen的确引起血小板减少,无论是整个临床试验期间还是post-baseline期间,volanesorsen能够引起药物相关的血小板减少。
在之前的专家委员会中,Akcea Therapeutics也公布了调整后的血小板监测方案和根据体重的剂量调整方案,但是该方案仍待在临床试验中进一步证实。
已有的临床数据并未很好回答WAYLIVRATM (volanesorsen)是否具有合理的收益风险比,该药物如果能够积极确定血小板监测方案和剂量调整方案能够有效规避风险,药物必将获批。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57