近日,宜昌人福在研品种“苯磺酸瑞马唑仑”及其注射剂,正式向国家递交NDA申请。该品种为1类新药,镇静类药物,完全顺应宜昌人福产品布局。但值得一提的是,就在今年3月恒瑞的“甲苯磺酸瑞马唑仑”(仅仅改变了该品种的盐型)却早于人福进入到NDA状态;那么,两个品种如此相近,进行对比就很有意思,且日后人福与恒瑞在该品种方面的竞争,也必将更加有趣,值得关注!
1、人福~苯磺酸瑞马唑仑~简介
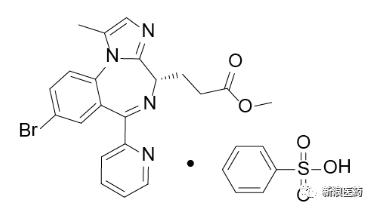
首先,瑞马唑仑由德国Paion公司开发,是一种短效GABAa受体激动剂,是苯二氮卓类中枢神经系统药物。2012年,Paion公司以300万欧元以及后续销售分成的合作协议授予人福药业在中国开发瑞马唑仑的权利,并于本月15日进入到NDA阶段。
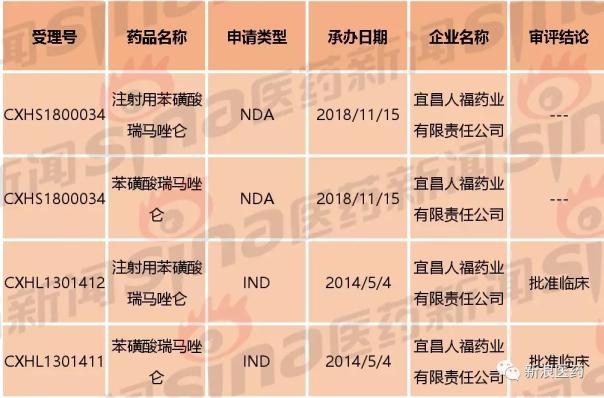
表1:苯磺酸瑞马唑仑重要注册信息
2、人福~苯磺酸瑞马唑仑~研发大事件
·2014年5月,宜昌人福药业向CFDA提交临床试验申请(化药1.1类);
·2015年6月,获得临床试验批件;
·2015年10月,注射用苯磺酸瑞马唑仑在健康志愿者中的单次给药安全性及药代动力学/药效学临床I期研究在中国完成首例受试者入组;
·2017年5月,注射用苯磺酸瑞马唑仑用于结肠镜检查镇静的耐受性、有效性和安全性的两中心、开放、剂量递增临床II试验在中国完成首例受试者入组;
·2018年4月,注射用苯磺酸瑞马唑仑用于结肠镜诊疗有效性和安全性的多中心、随机、单盲、阳性药物平行对照Ⅲ期临床试验在中国完成首例受试者入组,并且在中国的试验于2018年7月完成;
·2018年9月,计划启动在择期手术中评价注射用苯磺酸瑞马唑仑用于全身**诱导和维持的有效性和安全性的II期临床试验......
3、合成信息~简介
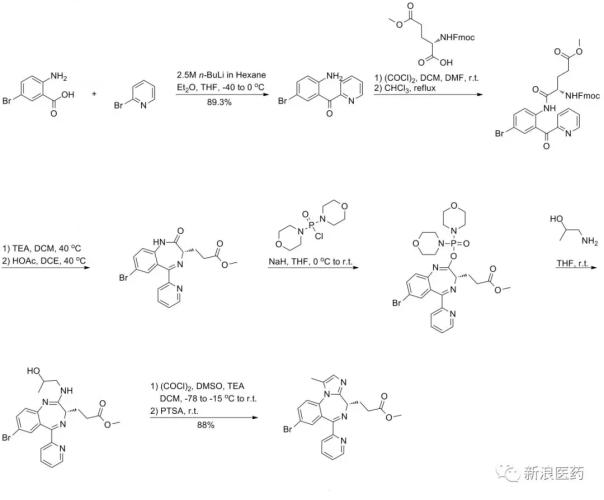
通过查询专利WO2011032692A1/ US7473689B2,瑞马唑仑可通过以下方法制得:
4、专利信息
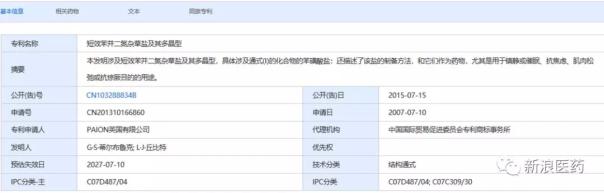
PAION公司,原研专利的中国申请号为CN201310166860,公开号为CN103288834B,申请日为2007.07.10,公开日为2015.07.15,详细信息见下表:
表2:苯磺酸瑞马唑仑原研专利
5、竞争对手,恒瑞~甲苯磺酸瑞马唑仑
无疑,恒瑞在这个品种上找到了漏洞,迅速开发甲苯磺酸盐,并于2013年4月获得中国化药1.1类临床批件,并于同年10月,迅速启动I期研究;2017年5月,项目就已经开展到了III期临床;2018年3月,甲苯磺酸瑞马唑仑在中国申报生产,并于4月获得优先审评。而进一步对比两家公司两个品种的临床状态,也很容易发现,恒瑞的研发速度、进度,都要更略胜一筹。对比见下表:
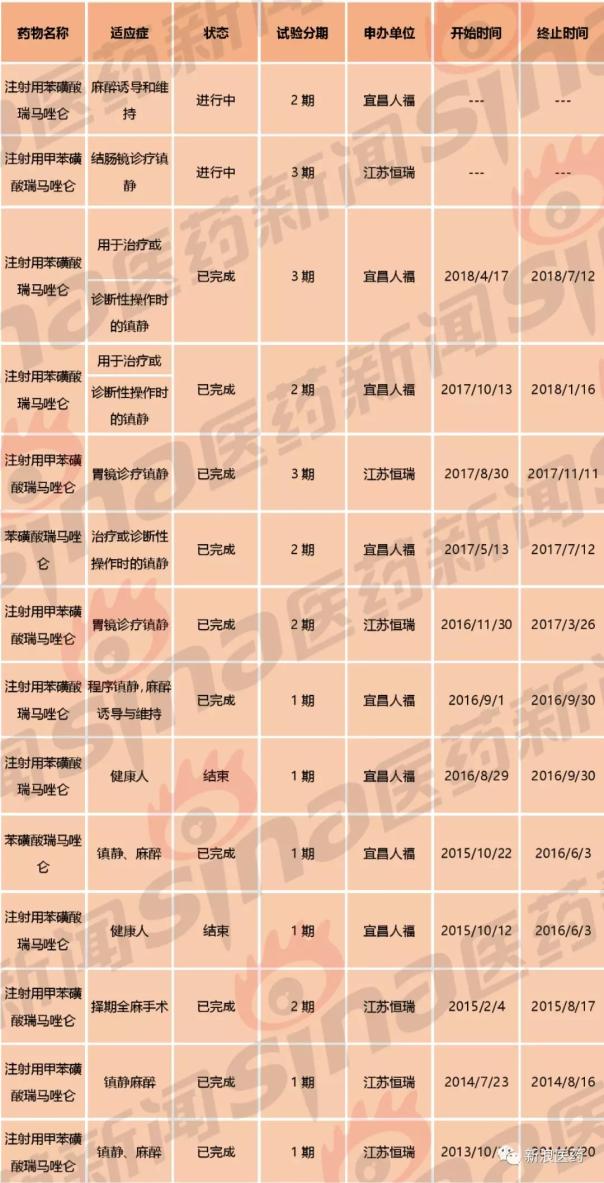
表3:两家“瑞马唑仑”的临床进展情况
6、结语
相信人福和恒瑞在这个产品的角逐上,故事绝对不少。参与的研发人员都比较幸运,能够经历如此1类新药的速度比拼过程;不过,该案例对于业界重复性不强,尤其是在知识产权越来越重要的今天,类似事件的发生几乎不可能……OK,回归主题,人福和恒瑞在这一产品的日后市场占有方面相信也会很有看头。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57