2018年11月30日,国家药品监督管理局批准艾美赛珠单抗(Emicizumab)上市,适应症存凝血因子Ⅷ抑制物的A型血友病患者,属于罕见病用药,药物审评走优化审评程序,简化上市要求。
截至12月09日,已有包括艾美赛珠单抗、Palbociclib在内多款药物通过简化审评程序加速上市。明显提高国内罕见病及临床急需药物的可及性。笔者将在此篇文章更新第一批临床急需新药审评进展。
一. 第一批临床急需新药审评进度更新
2018年11月01日,国家药品监督管理局审评中心发布公告--《关于发布第一批临床急需境外新药名单的通知》,40个品种名单按程序对外公布,名单中药物可通过专门通道加快审评,尚未申报的品种,可直接提出上市申请。
1个月后,笔者特地更新了名单中审评审批进度,其中多款药物已经获批上市或将要获批。
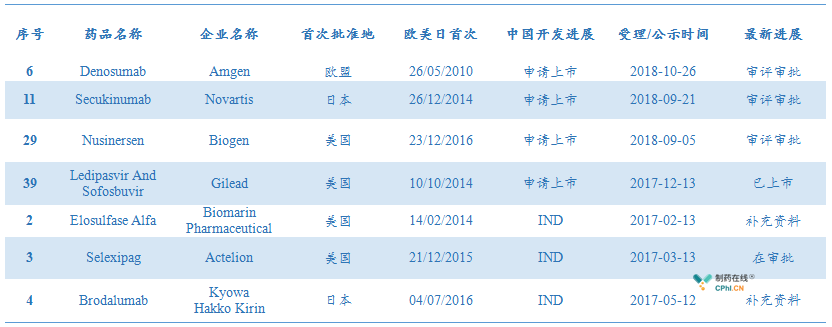
例如上表中,吉利德丙肝DAAs药物索非布韦雷迪帕韦,商品名Harvoni,已经获批上市;Actelion肺动脉高压药物Selexipag处于在审批,也将于近期获批。
二.8款罕见病/临床急需药物火速上市
随着优先审评通道和简化审评程序的持续推进,笔者搜集了8款通过该程序在中国获批上市的药物,绝大多数药物以国际多中心临床试验数据提出免做进口临床试验的注册申请,药物进入中的时间大大缩短,这当然提高了罕见病药物和临床急需药物的可及性。
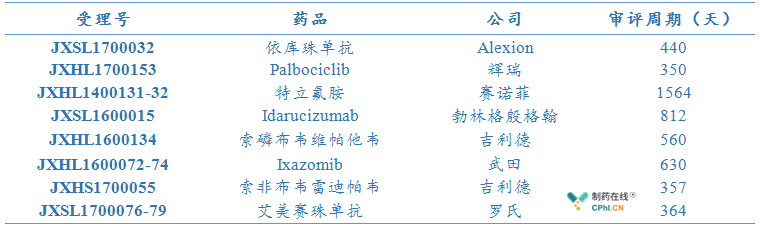
这其中,罕见病药物依库珠单抗的上市更为迅速,2018年09月04日,国家局批准依库珠单抗 进口注册申请,审评审批仅用440天,该药物的批准上市具有重要意义,该药物值得关注的点:
1.豁免注册临床
2.无中国人群临床数据
3.成人和儿童适应症同时获批
4.有条件批准+上市后评价
这类药物虽是罕见病药物,无任何中国人群临床数据。
第一批临床急需药物名单中:
已在/正在中国开展国家多中心临床试验的有6款:
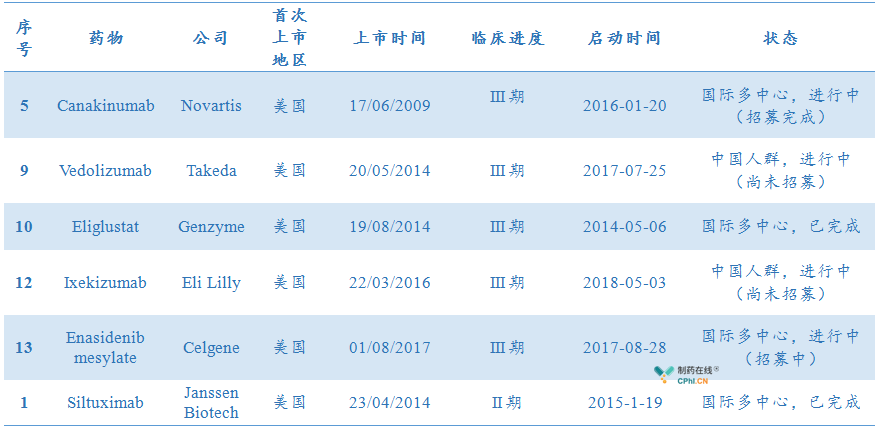
药物未来在中国的上市将会进一步提速。
尚未在中国有任何申报记录的:
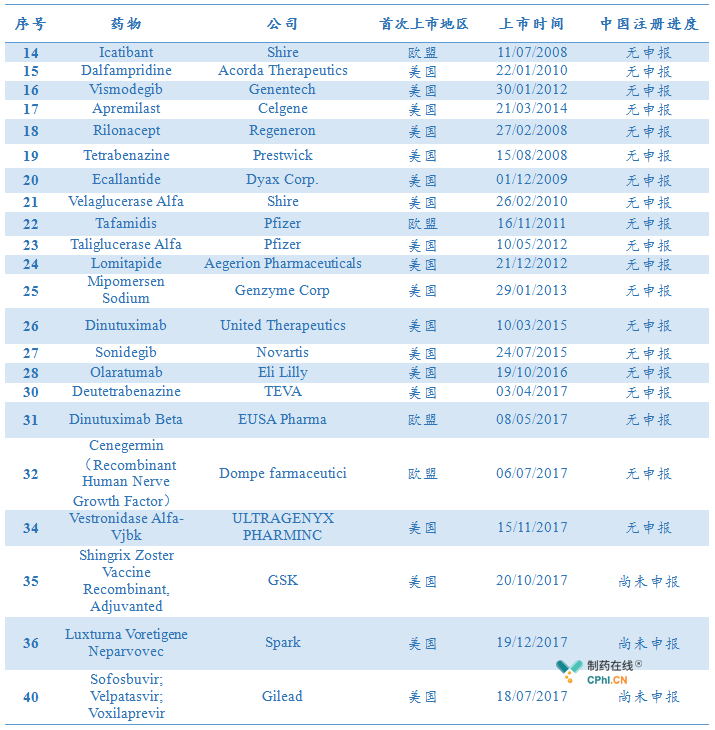
国家药品监督管理局继续加快境外已上市新药在我国进口注册的速度,对治疗罕见病的药品和防治严重危及生命疾病的部分药品优化审评程序,简化上市要求,明显提高药物可及性。有条件批准+上市后审评模式越来越多应用在罕见病药物中后,应该着力加大这种模式的上市后监需,积极控制药物早期用药风险并强力推进药物进行上市后评估和审评,昂贵的罕见病用药上市后再补做临床试验,这很困难;另外,罕见病用药可及之后,仍旧价格昂贵,这也是罕见病药物可以忽略中国市场的原因,如何在有效提高可及性后,合理控制或是增加患者的支付能力,创新支付方式,这同样是一个值得关注的问题。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57