
如果一个产品,年销售额贡献率接近90%,那产品价值的不断开发,产品的升级将是至关重要的,罕见病药物依库珠单抗(商品名Soliris)对于Alexion便是这样一款举足轻重的重磅资产。
2018年12月21日,FDA批准第59款药物,依库珠单抗的继承者ULTOMIRIS™(ravulizumab),用于治疗阵发性夜间血红蛋白尿治疗,这就是依库珠单抗的继承者--长效版Soliris,药物批准比预期早了2个多月。本文关ULTOMIRIS™的临床试验数据以及Soliris/ULTOMIRIS的商业开发计划。
一.全球销售额TOP30:Soliris是一款重磅罕见病药物
依库珠单抗有3个适应症
依库珠单抗2007年首次在美国上市,2018年09月04日,该款药物在中国获批。目前,Soliris(依库珠单抗)已获批3个适应症,即治疗阵发性夜间血红蛋白尿(PNH),非典型溶血性尿毒症综合征(aHUS),和抗AchR抗体阳性重症肌无力(gMG) 。
依库珠单抗很贵
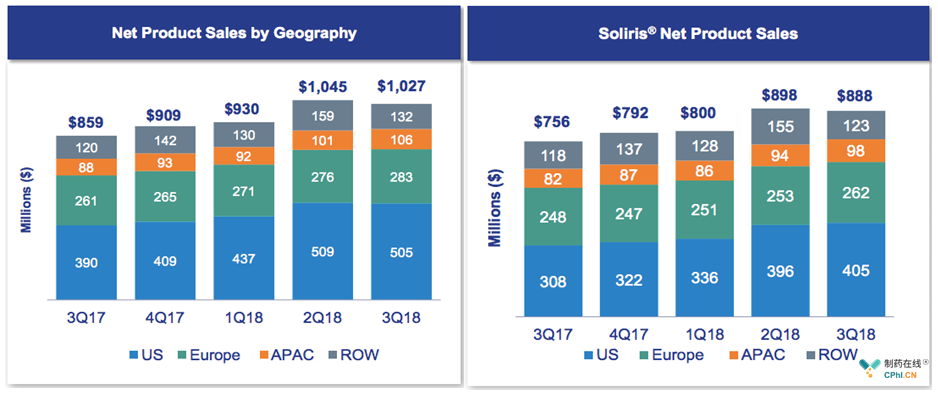
定价50多万美金/年,约合RMB 300万/年,2017年销售额31.44亿美元,占公司全年销售额88.53%,全球药物销售排名约在TOP30。
依库珠单抗专利2027年到期
Soliris在美国专利将于2027年到期,面对类似药和创新药的竞争,Alexion当然很慌,而ULTOMIRIS的成功上市有望将专利延长至2035年。
2018年第3季度财报数据:Soliris贡献86%销售额
二.长效版Soliris:ravulizumab临床数据分析
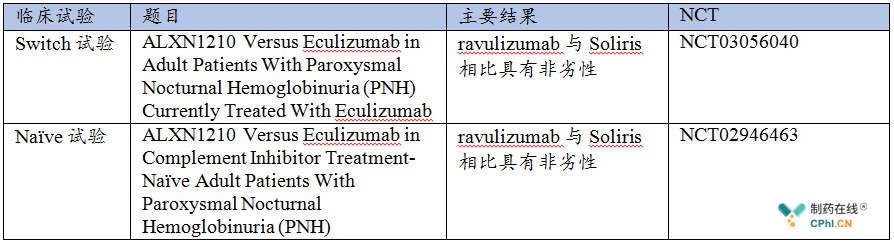
开发Soliris的升级版ravulizumab,这是Soliris价值化的一个方面, ravulizumab的获批上市基于两项非常关键的临床试验,即Switch试验,Naïve试验。
PNH适应症:ALXN1210临床数据总结
1. Naïve研究,在初治PNH患者中,ravulizumab与Soliris相比具有非劣性
2. Switch研究,在Soliris治疗病情稳定的PNH患者中,ravulizumab与Soliris相比具有非劣性。
两项临床试验信息如下:
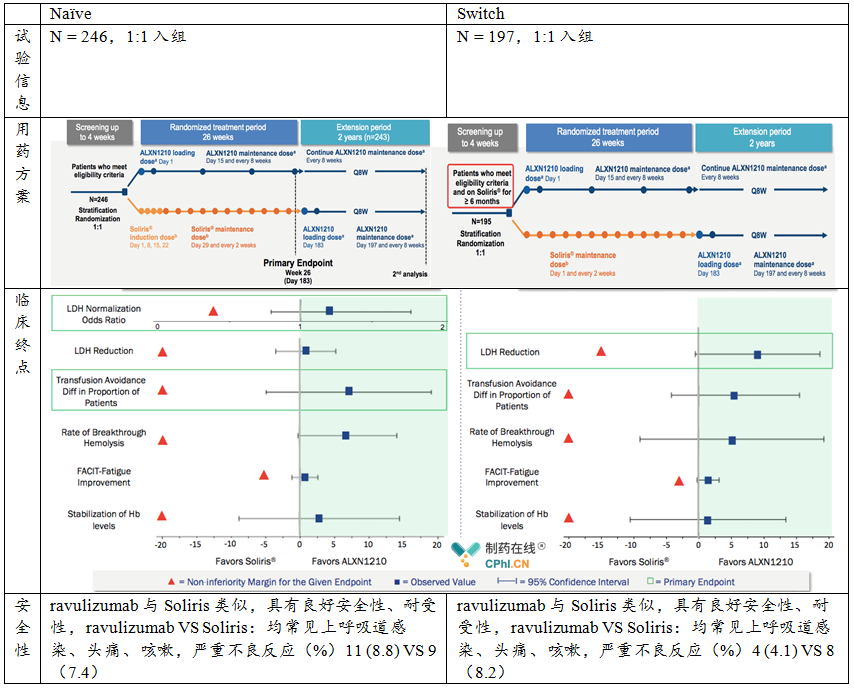
Naïve试验和Switch试验
三.依库珠单抗与ravulizumab的商业规划
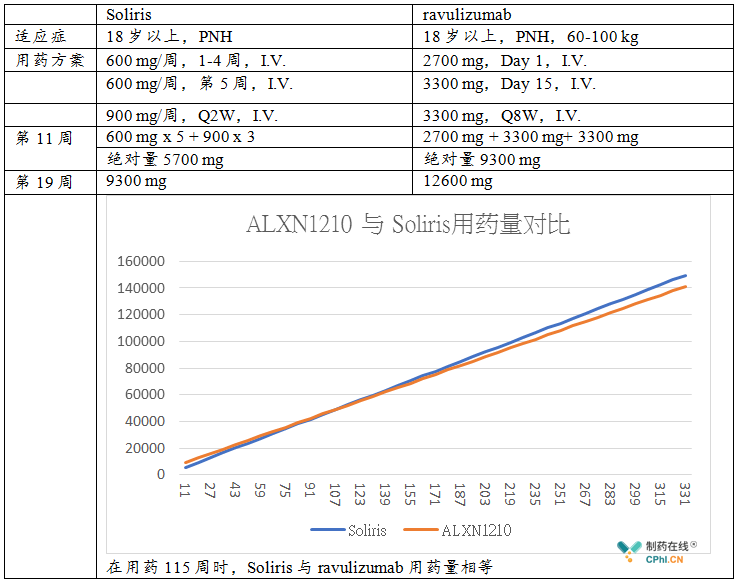
ravulizumab目前定价尚未公布,假设ravulizumab与依库珠单抗相当,那么ravulizumab未来卖点:
1. 依从性高,这也许是ravulizumab未来卖点,维持治疗时Q8W相比 Q2W具有一定的优势,尤其是ravulizumab正在开发皮下注射制剂,这对ravulizumab来说,具有市场发展潜力。
2. 费用方面,ravulizumab是长效制剂,定价方案仍未公布,笔者以18岁以上PNH成人患者为例,比较ravulizumab和Soliris的用药量。有这样几个点:a. 用药115周,两种药物绝对用量相等;b.用药三年之后,ravulizumab绝对用量减少1800 mg/年,Soliris目前定价约为17.3美金/mg,若ravulizumab价格也为17.3美金/mg,ALXN1210有望每年节省3.1万美金。
其他方面,有效性当然没问题,安全性和耐受性也和Soliris相同。
Soliris:继续拓展依库珠单抗的商业价值
依库珠单抗上市11年来,先后上市3个适应症,同时仍有多个适应症处于临床开发中,已上市3个适应症中,抗AchR抗体阳性重症肌无力(gMG)适应症获批以来,销售额健康增长,2018第3季度销售额已达到5.6亿美元。
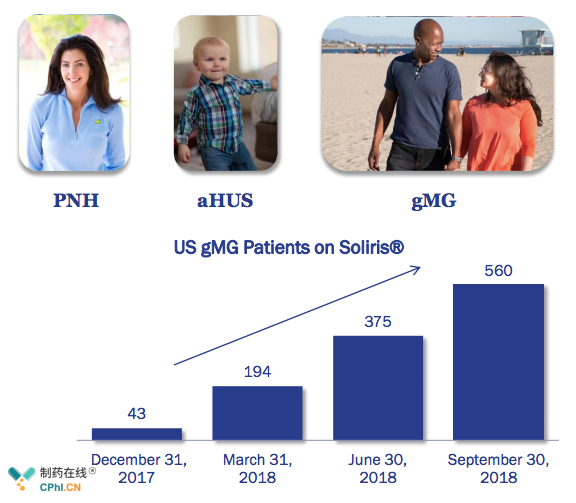
此外在适应症视神经脊髓炎谱系疾病(Neuromyelitis Optica Spectrum Disorder)将于2019年迎来重要里程碑,公司即将递交上市申请,继续拓展依库珠单抗的商业价值。
Ravulizumab:做一个合格的Soliris继承者
继承依库珠单抗的衣钵,继续依库珠单抗的辉煌,这是Alexion给Ravulizumab的重要使命,PNH适应症获批后,还有适应症aHUS,gMG,IgAN等着Ravulizumab开疆拓土。
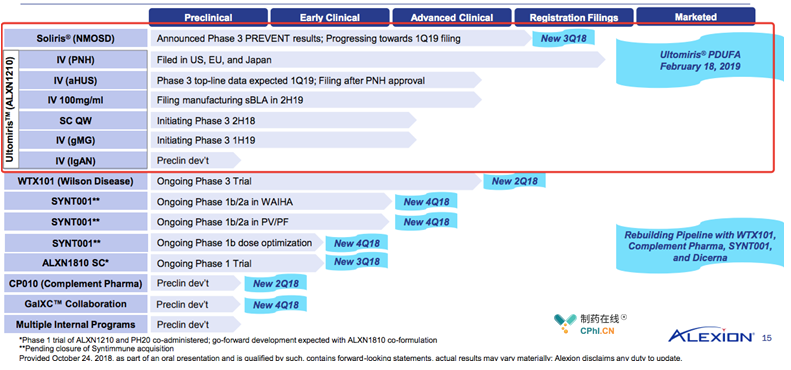
附:
Ravulizumab长效机制:
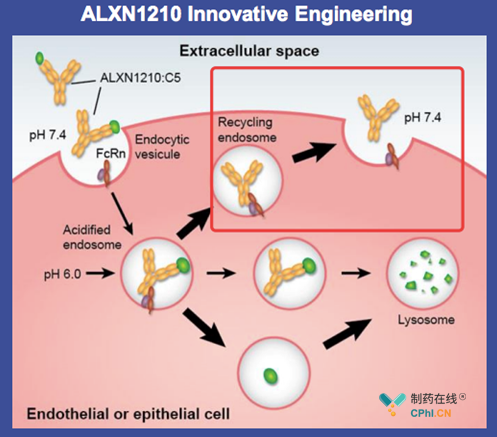
Ravulizumab通过Fc段基因工程改造,提高Fc-FcRn在 PH 6.0亲和力,延长了抗体半衰期,Ravulizumab:1.半衰期达42天;2.全球近35国家的专利延长至2035年;3. PNH和aHUS两个适应症在美国获得孤儿药资格。笔者并没有查阅ALXN1210的专利(US9079949B),感兴趣的读者可以查看其相关专利,关注其基因工程方案。相关专利包括US9371377; US9079949; US9663574。
参考资料:
Alexion2018年第3季度财报



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57