2019年4月24日,诺华(Novartis)公布2019Q1财报,制药业务营收111亿美元,同比增长7%;创新药业务收入87.8亿美元,同比增长10%;仿制药业务收入23.3亿美元,同比下滑2%。
2019年Q1,诺华创新药业务主要驱动力是银屑病产品Cosentyx、心衰产品Entresto以及肿瘤产品Lutathera、Promacta、Kisqali和Kymriah;2019年3月复发型多发性硬化症重磅产品Mayzent获批上市,也是首款治疗继发性进展型多发性硬化症的产品,其他2019年预计上市重磅产品还有Zolgensma、Alpelisib和Brolucizumab。
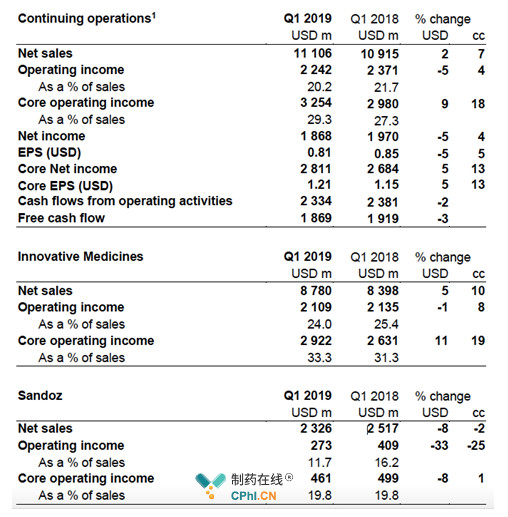
Cosentyx引领第一,Entresto紧随其后,肿瘤产品不甘落后
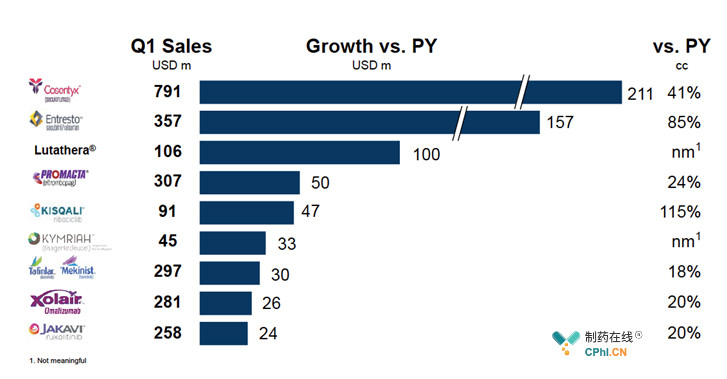
Cosentyx:销售额同比+41%,决胜银屑病、强直性脊柱炎市场
2019Q1,Cosentyx的销售额达到7.91亿美元,同比+41%,已然成为诺华创新药的老大哥。此外,2019年3月28日,Cosentyx获得NMPA批准在国内上市,用于成人中重度银屑病的治疗,击败强生和礼来,开启国内销售之旅。
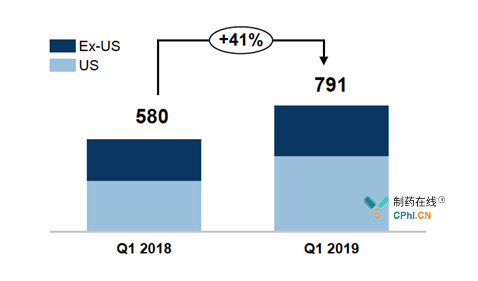
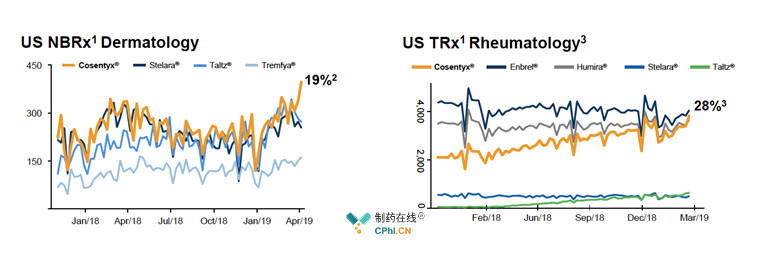
Cosentyx于2015年1月获批治疗银屑病,2016年1月获批适应症强直性脊柱炎和银屑病关节炎,不断开展临床试验进行适应症拓展,如和Stelara的头对头对比试验、对银屑病、银屑病关节炎和强直性脊柱炎的5年长期收益研究等。现如今,Cosentyx已经超过对手Stelara、Taltz、Tremfya,成为银屑病市场的主导产品;同时,在强直性脊柱炎领域,Cosentyx也在奋起直追,目标第一!
Entresto:销售额同比+85%,PIONEER-HF试验添光彩
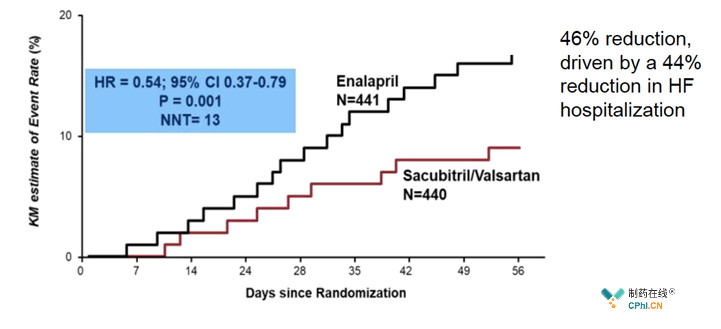
2019Q1,Entresto(Sacubitril/Valsartan)销售收入3.57亿美元,同比+85%;其中PIONEER-HF临床试验的成功让Entresto更加光彩夺目。
2018年11月,诺华公布Entresto具有里程碑意义的PIONEER-HF试验结果,与心衰常规药物Enalapril相比,显著降低心衰标志物NT-proBNP水平。更重要的是,Entresto降低NT-proBNP的效果在因ADHF入院的不同HFrEF患者群体中具有一致性,包括那些新诊断的HFrEF患者、未接受ACEi/ARB治疗的患者以及非裔美国人。
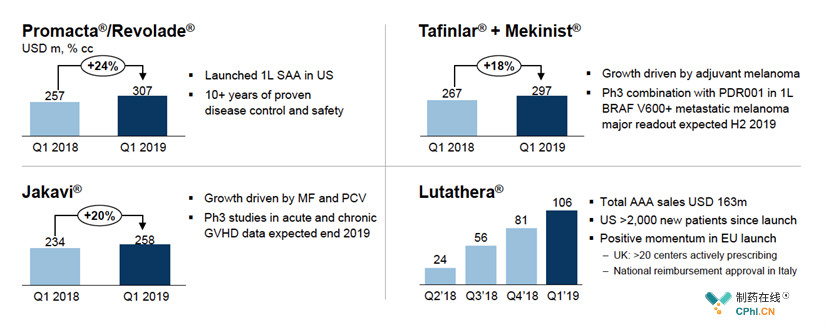
肿瘤产品:Promacta/Revolade、Tafinlar + Mekinist、Jakavi、Lutathera
2019Q1,诺华肿瘤学产品销售额同比增长9%,主要得益于:一线再生障碍性贫血疗法Promacta/Revolade(+24%)、BRAF V600E/K突变黑色素瘤辅助疗法Tafinlar + Mekinist(+18%)、骨髓纤维化疗法Jakavi(+20%)以及罕见消化道癌疗法Lutathera。
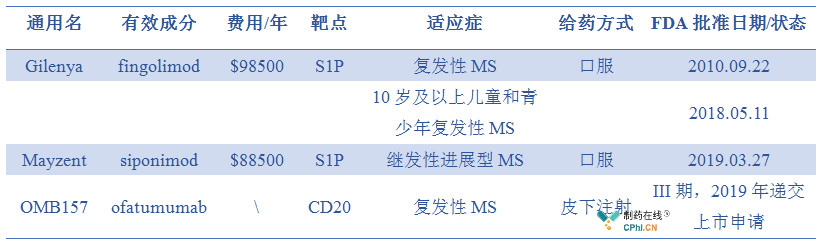
复发型多发性硬化症重磅产品Mayzent获批!
2019年3月27日,基于III期临床试验EXPAND的优异数据,FDA批准Mayzent上市,用于治疗复发型多发性硬化症(MS),包括复发缓解型(RRMS)、继发性进展型(SPMS),这也是首款获批用于治疗SPMS的产品。

Mayzent是诺华第2款获得FDA批准的MS产品,被认为是继Gilenya(fingolimod)后诺华多发性硬化症的主力产品。
诺华的的多发性硬化症资产:
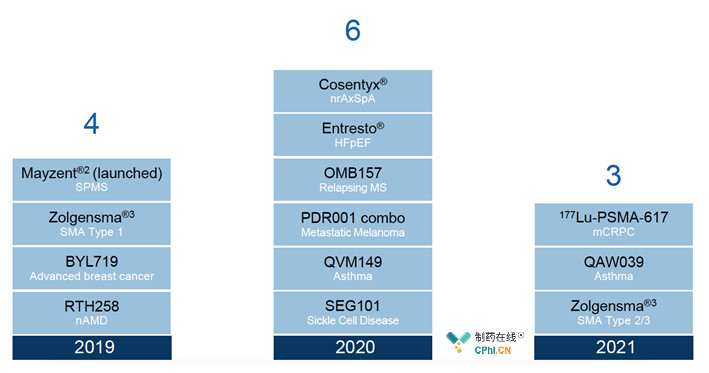
其它2019Q1诺华获批的产品:

即将到来的重磅产品:Zolgensma、Alpelisib、Brolucizumab
Zolgensma:一次性脊髓性肌萎缩基因疗法
2019年4月16日,诺华公布其基因疗法Zolgensma治疗I型脊髓性肌萎缩症(SMA)的III期临床试验STR1VE的中期数据,与未接受治疗的患者相比,Zolgensma可以显著延长患儿的无事件生存期,预计2019年5月获批在美国上市。
SMA是一种因编码广泛运动神经元生存蛋白(SMN)的基因SMN-1双等位基因缺失或突变引起的疾病,会使患者丧失呼吸、吞咽、说话和行走等能力。Zolgensma利用AAV9向患者体内引入SMN替代基因,从而使患者可以正常表达SMN,恢复行动能力。
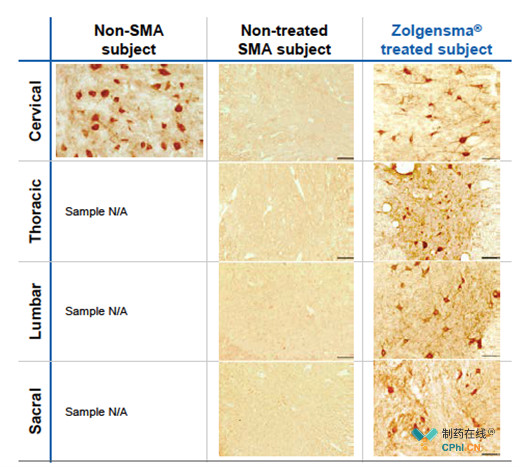
Zolgensma是唯一一款一次性基因疗法,目前已有超过150名患者接受治疗,仅有5%的患者因AAV9表达量不足而中止治疗。诺华认为Zolgensma的定价在400万美元/例也是具有合理性的,有分析师预测2023年期销售额将达到20.8亿美元。
Alpelisib:诺华第二款乳腺癌开创性疗法
Alpelisib(BLY719)是一款口服α亚型特异性PI3K抑制剂,强力抑制PI3K信号通路,从而达到抑制肿瘤细胞增生的效果,大约有40%的HR+/HER2-晚期乳腺癌患者携带PIK3CA突变,但目前没有针对她们的靶向疗法。
根据2018年10月公布的III期临床数据,与Fulvestrant单药疗法相比,Alpelisib+Fulvestrant联用可以使患者的无进展生存期中值提高近两倍,并且显著改善总缓解率,预计2019H2获批上市。

Brolucizumab:湿性年龄相关性黄斑变性疗法
Brolucizumab是一款人源化单链抗体片段(scFv),能够抑制所有的VEGF-A亚型,从而抑制VEGF信号通路介导的血管增生,用于治疗新生血管性年龄相关性黄斑变性(nAMD,湿性AMD)。
根据2018年公布的两项III期临床试验HAWK和HARRIER的数据,与获批nAMD疗法Aflibercept相比,Brolucizumab在改善患者视力方面达到非劣效性标准,并且在减少患者视网膜积液方面有更好的表现。
基于HAWK和HARRIER的数据,2019年4月诺华已经向FDA递交了Brolucizumab的上市申请,预计2019年年底获批上市。
参考来源:Novartis starts 2019 with strong sales and double digit core operating income growth, Mayzent launch and Alcon spin-off; profit guidance upgraded
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57