2019年04月25日,复宏汉霖宣布NMPA受理曲妥珠单抗HLX02上市申请,受理号为CXSS1900021,此次申请适应症为HER2+早期乳腺癌、转移性乳腺癌、转移性胃癌。HLX02为复宏汉霖4个核心产品之一,药物在中国、波兰、乌克兰以及菲律宾开展全球3期临床试验,药物中国上市是产品开发和商业化的一个里程碑进展,截至目前,罗氏曲妥珠单抗全球上市21年,中国上市17年,2018年全球销售额69.82亿瑞士法郎,中国销售额约27亿人民币,HLX02中国上市将会惠及更多癌症患者,切实降低患者医疗支付压力!
本文简述了HLX02药物开发历程,同时根据复宏汉霖公开资料总结了药物的关键发展节点。
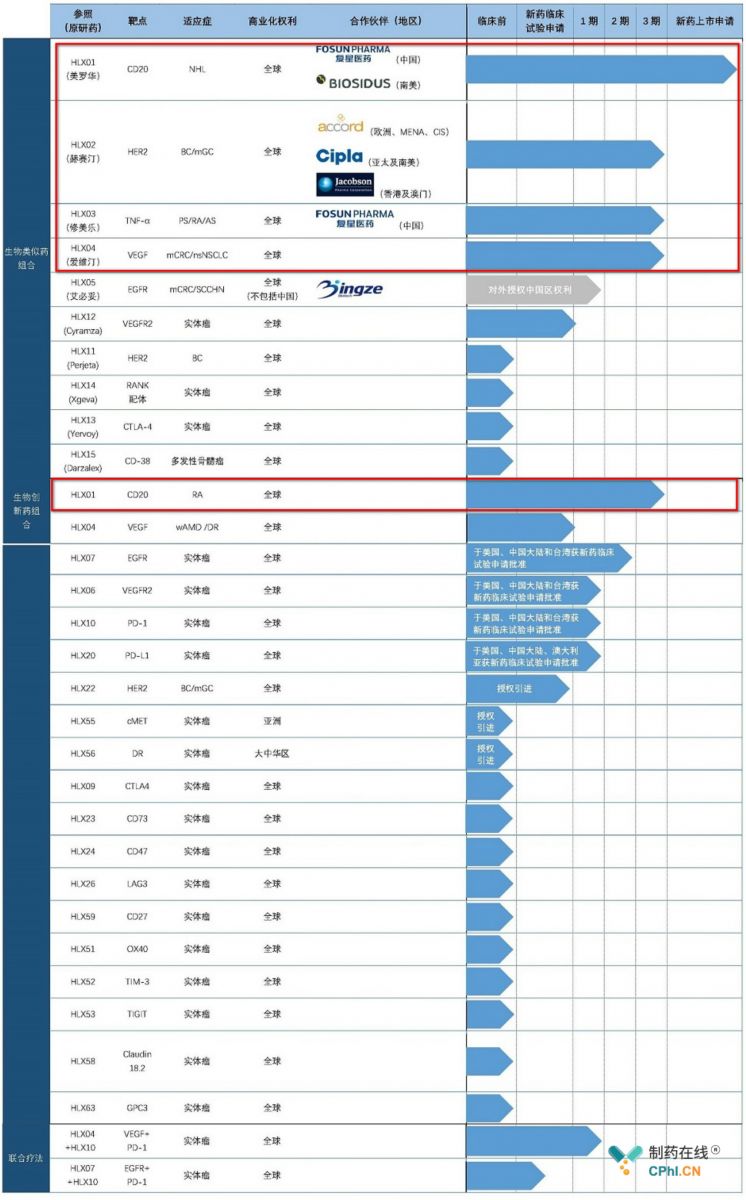
一. HLX02:曲妥珠单抗从中国走向国际
曲妥珠单抗HLX02是复宏汉霖最为核心的4大产品(HLX01, 02, 03, 04)之一,项目自2011年05月启动,目前已经历时8年,HLX02成为首个在中国开发并同时在全球多个地区(亚洲的中国、菲律宾,欧洲的波兰、乌克兰)进行3期临床试验的生物类似药。同时,复宏汉霖已与Accord、Cipla以及雅各臣签订合作商业化协议,进一步加速药物的国际化进程。
招股说明书
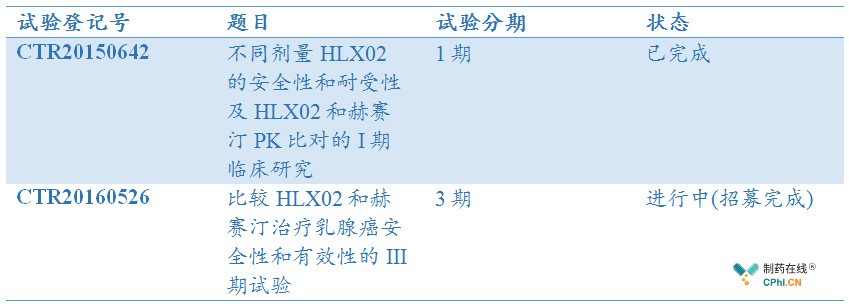
HLX02的1期和3期临床试验开发进展简述:
资料参考CDE临床试验登记中心
根据笔者查询到的信息,HLX02有两项临床试验登记信息,分别为CTR20150642和CTR20160526,其中:
1. CTR20150642数据显示:HLX02与赫赛汀具有相似的安全性、耐受性
CTR20150642
专业题目:一项评价不同剂量HLX02的安全性和耐受性及HLX02和赫赛汀的药代动力学特征、安全性、耐受性和免疫原性的I期临床研究
入组患者:123例,
首例入组:2015年09月22日
完成日期:2016年05月11日
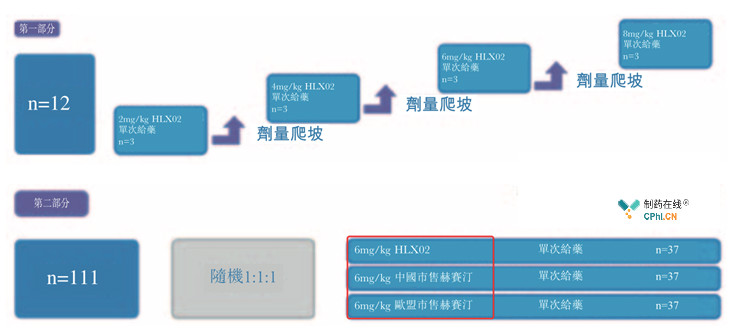
试验设计如下
复宏汉霖招股说明书
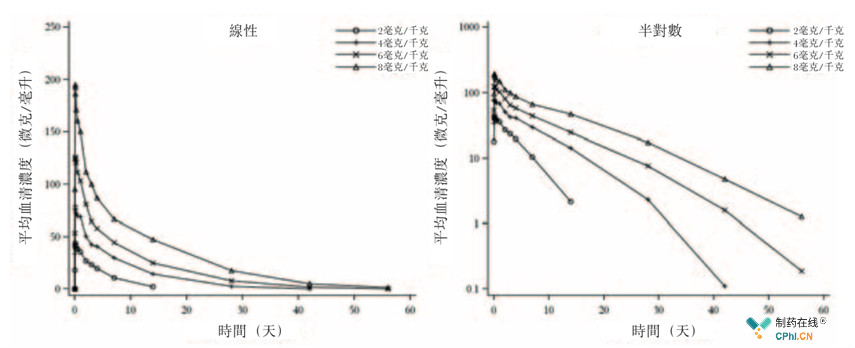
该1期临床分为两部分,即第1部分为开放、计量爬坡,12例中国健康男士接受2,4,6,8 mg/kg 单剂量HLX02。数据显示,HLX02药代动力学与剂量成正相关,不同剂量药物均具有良好耐受性。
复宏汉霖招股说明书
试验第2部分为多中心、随机、双盲研究,111例患者1:1:1入组,分别接受6 mg/kg HLX02,中国销售赫赛汀以及欧盟销售赫赛汀。数据显示,HLX02 vs 中国赫赛汀 vs 欧盟赫赛汀,AUC0-inf (90% CI )几何平均值分别为0.914,0.950,0.962;均值的90% CIs 在预设等值范围80 - 125%
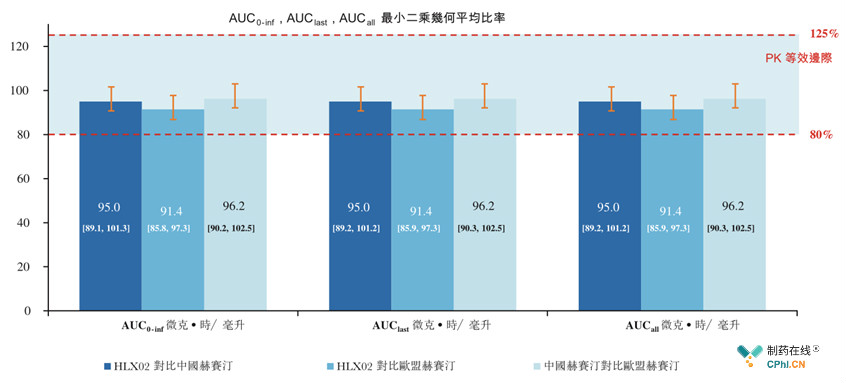
复宏汉霖招股说明书
药物安全性:良好
试验第1部分,共计报告8例不良反应,均为治疗诱发不良事件(TEAE),其中7例为ADR,常见为谷丙转氨酶升高、嗜睡及头晕,未发生SAE、推出治疗或死亡;
试验第2部分,3组安全性结果具有可比性,统计无差异,均未检测出CTCAE III级以上不良事件、死亡或严重不良事件(SAE)。
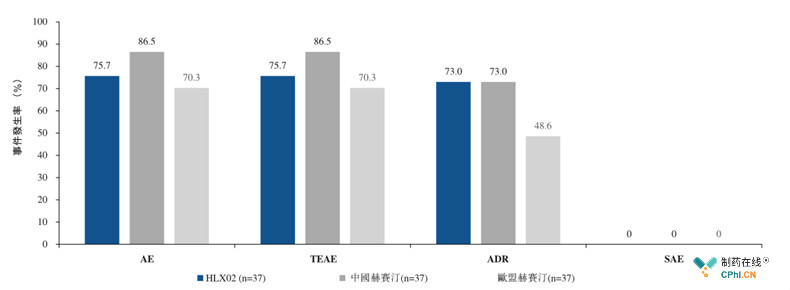
复宏汉霖招股说明书
免疫原性良好,第2部分3个治疗组中,ADA检测结果均为阴性。
2. CTR20160526:多中心临床仍在进行中
CTR20160526
专业题目:比较HLX02与赫赛汀治疗未经治疗的HER2+转移性乳腺的疗效、安全性和免疫原性的3期临床试验

2016年11月11日,CTR20160526第一例患者完成入组,2018年06月完成招募,试验仍在进行中,该临床试验获得"重大新药创制"-十三五科技重大专项;"科技创新行动计划"生物医药领域科技支撑项目支持,项目编号2018ZX09736016; 16431901300。
该3期临床试验适应症为未经治疗的HER2+转移性乳腺,上市申请适应症外推至了HER2+早期乳腺癌以及HER2+转移性胃癌适应症。临床试验结果尚未公布,可持续关注。
3. 曲妥珠单抗HLX02重要发展节点
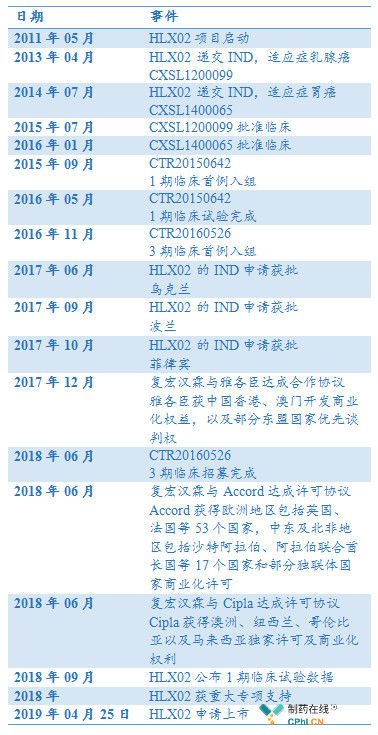
二.超级重磅药物:曲妥珠单抗
曲妥珠单抗原由罗氏开发上市,1998年09月首次在美国获批上市, 曲妥珠单抗是罗氏3款超级重磅炸 弹药物之一,已累计带来800多 亿瑞士法郎销售收入。
2002年,赫赛汀(曲妥珠单抗)进入中国,目前已经进入国家医保目录和2018基本药物目录,定价为440 mg: 20 ml,7600元人民币,患者支付压力仍是很重,复宏汉霖HLX02上市将会切实缓解患者支付压力。
截至目前,全球已有5款曲妥珠单抗生物类似药在欧洲、美国先后获批上市,其中,欧盟获批上市5款,美国获批上市4款,详见笔者文章《盘点欧盟和美国已获批生物类似药》。
欧盟已获批上市的曲妥珠单抗生物类似药:
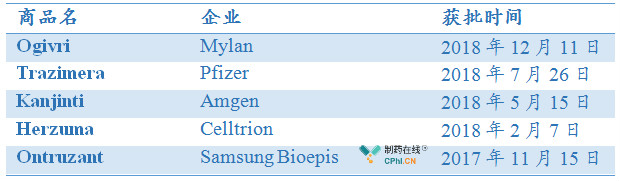
美国已获批上市的曲妥珠单抗生物类似药:
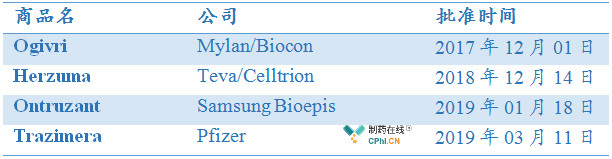
曲妥珠单抗HLX02立足中国,走向国际,正如上文所述,药物在全球多个关键市场与合作伙伴建立合作,加速国际化进程,该药物成为及利妥昔单抗生物类似药、阿达木单抗生物类似药之后,复宏汉霖第3款申请上市的生物类似药,2018年12月14日,复宏汉霖向港交所递交招股说明书,复宏汉霖无疑成为中国生物类似药领域脱颖而出的佼佼者。
点击下图,预登记观展



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57