7月中旬,业界流传出国家医保局关于药品4+7集采扩面企业座谈会纪要,其内容主要包含:
1. 药品范围:第一批中选的25个通用名;
2. 地区:除 4+7 城市以及福建河北两省外的全国所有省份及地区;
3. 企业范围:所有此轮开标前通过一致性评价品种的原研及仿制药生产企业;
4. 约定用量:全部地区公立医院、定点民营医院、军队医院上报用量按一定比例作为约定量。若一家中标给予50%量,两家中标给60%量,三家中标给70%量;
5. 竞标规则:所有企业(包括原研企业)以不高于4+7中标价格申报,报价的企业直接中选,其余企业依次决定是否接受报价,直到中选企业满 3 家(或3家以上,待决策)。根据报价高低,企业交替轮流选择省份(1,2,3,1,2,3……),所挑选省份报的量总和即是此企业约定的量;
6. 周期:2 家中标品种 1 年,3 家(或 3 家以上)中标品种 2-3 年;
另据了解,正式文件将于今年 10 月前发出,年底招标,明年开始执行。据此,业内也掀起了新一轮的药品降价潮。
那么,此前中选的25个通用名,其中标企业将面临哪些原研厂商及通过一致性评价厂家的挑战?竞争态势如何?此外,截至目前仿制药一致性评价申报情况如何?7月份新通过的品种都有哪些?我们带你先睹为快!
一、25个第一批4+7中标药品及通过一致性评价厂家汇总
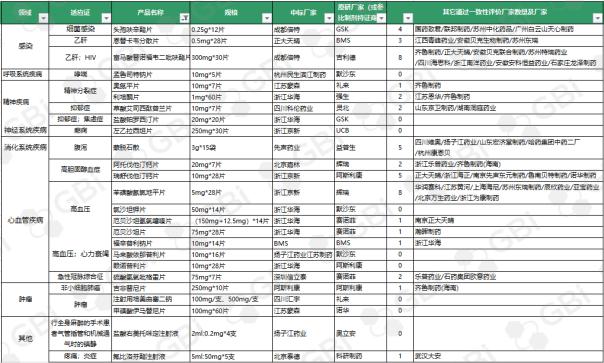
以上表格统计了截至2019年7月29日,25个第一批4+7中标药品通过一致性评价的企业情况。
二、2019年7月新增通过仿制药一致性评价品规
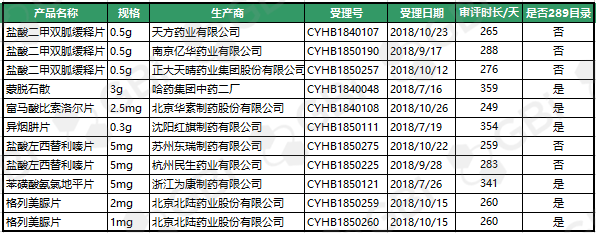
截至2019年7月29日,7月份新增11个品规通过仿制药一致性评价。其中:6个品规为289目录品种。
三、2019年7月新增视同通过仿制药一致性评价品规
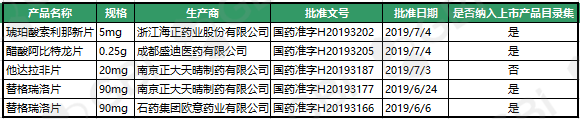
GBI SOURCE数据库显示,截至2019年7月29日,7月份新增视同通过仿制药一致性评价品规5个,其中4个已被纳入《中国上市药品目录集》。
四、仿制药一致性评价通过企业达3家及以上品规
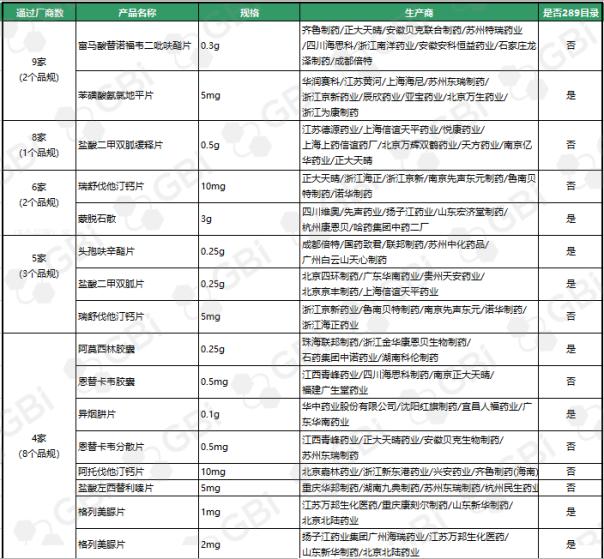
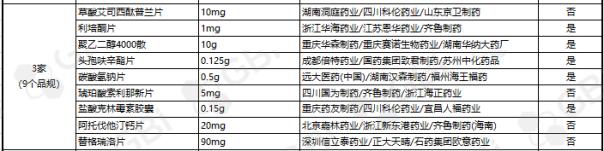
截至目前,通过仿制药一致性评价或视同通过仿制药一致性评价通过企业达 3 家及以上品规共有25个。其中:
◆ 富马酸替诺福韦二吡呋酯片(0.3g)、苯磺酸氨氯地平片(5mg)有9家通过;
◆盐酸****缓释片(0.5g)有8家通过;
◆瑞舒伐他汀钙片(10mg)、蒙脱石散(3g)有6家通过;
◆头孢呋辛酯片(0.25g)、盐酸****片(0.25g)、瑞舒伐他汀钙片(5mg)有5家通过;
◆阿莫西林胶囊(0.25g)、恩替卡韦胶囊(0.5 mg)、异烟肼片(0.1g)、恩替卡韦分散片(0.5 mg)、阿托伐他汀钙片(10mg)、盐酸左西替利嗪片(5mg)、格列美脲片(1mg)、格列美脲片(2mg)8个品规目前已有4家企业通过仿制药一致性评价;
◆通过企业达 3 家的9个品规分别是:草酸艾司西酞普兰片(10mg)、利培酮片(1mg)、聚乙二醇4000散(10g)、头孢呋辛酯片(0.125g)、碳酸氢钠片(0.5g)、琥珀酸索利那新片(5mg)、盐酸克林霉素胶囊(0.15g)、阿托伐他汀钙片(20mg)、替格瑞洛片(90mg)。
五、仿制药一致性评价总体进展
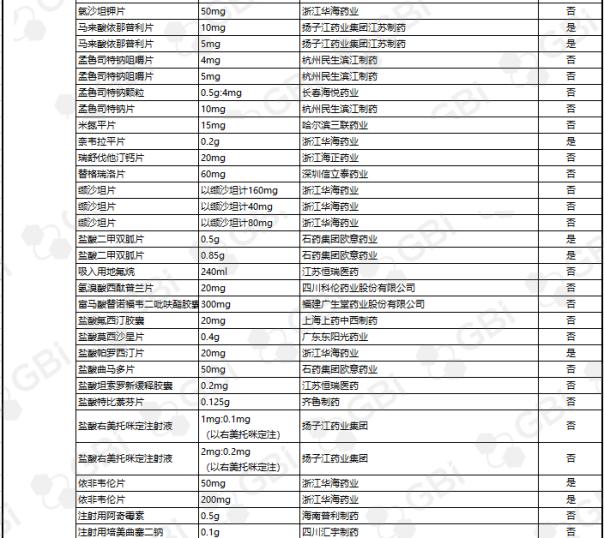
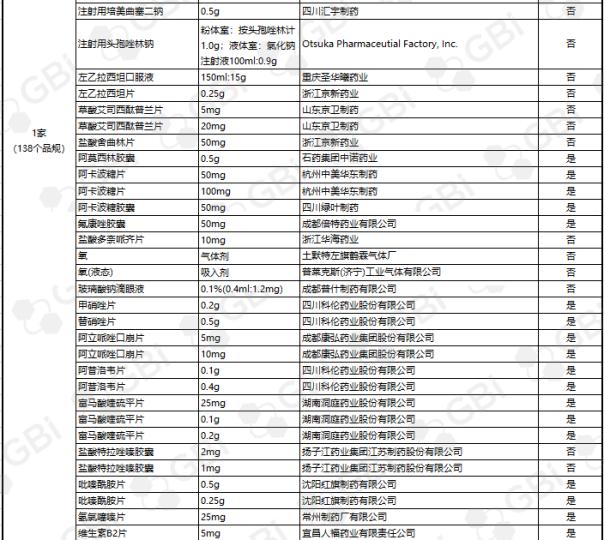
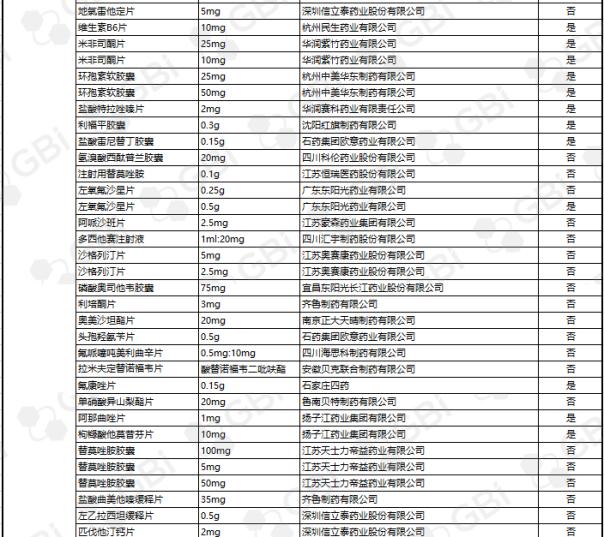
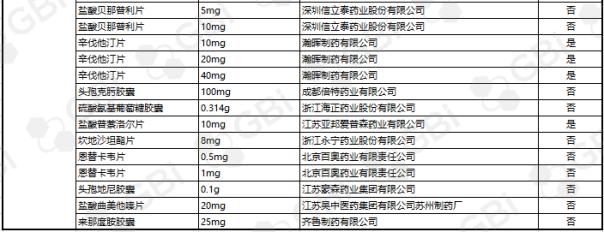
据GBI SOURCE数据库显示,截至2019年7月29日,CDE有关仿制药一致性评价累计受理号已达1324个,涉及385家企业的302个品种,目前已有298个品规通过或视同通过仿制药一致性评价。其中:2个品规通过企业达9家;1个品规通过企业达8家;2个品规通过企业达6家;3个品规通过企业达5家;8个品规通过企业达4 家;9个品规通过企业达 3 家;24个品规通过企业达2家;138个品规通过企业达1家(详细名单见下表)。
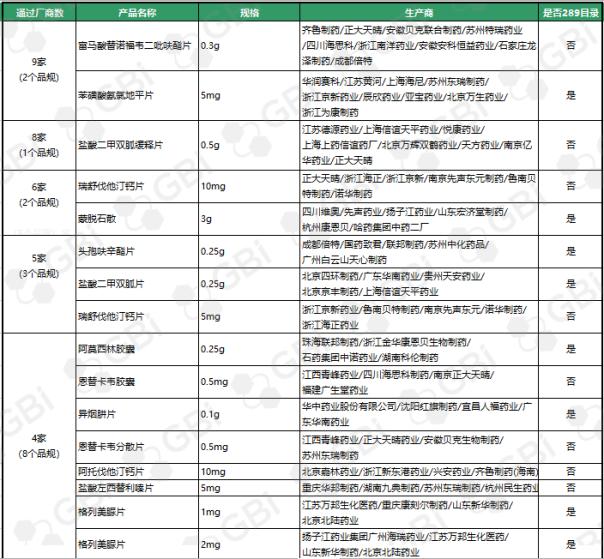
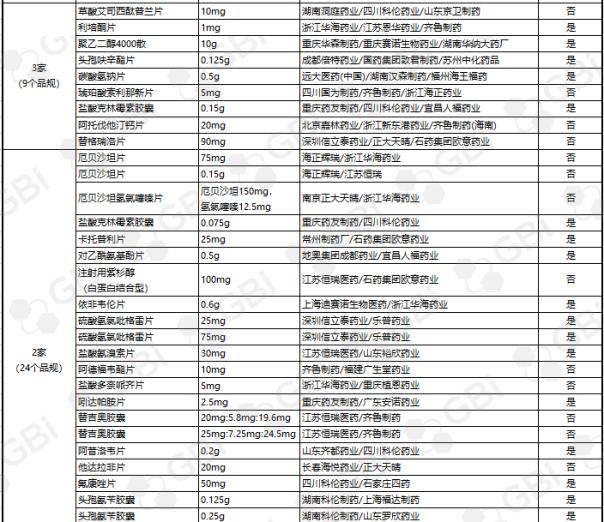
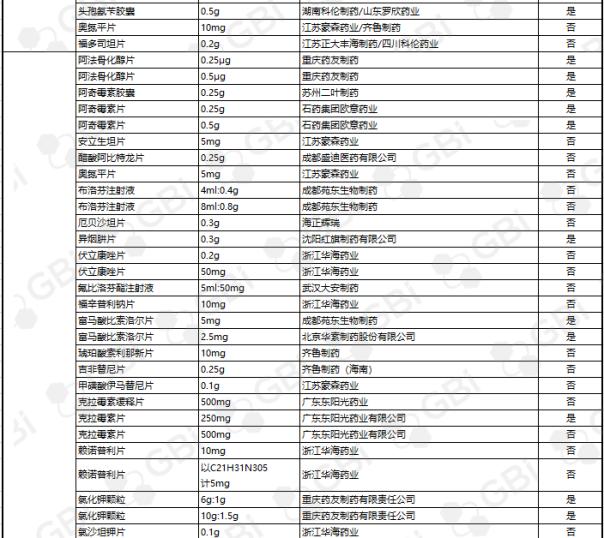
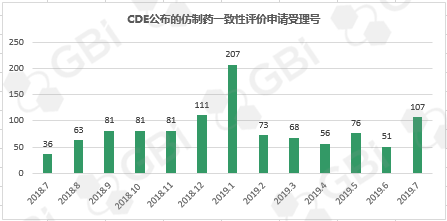
六、CDE受理仿制药一致性评价变化趋势
据GBI SOURCE数据库【药品申报情况统计】工具统计的结果显示,2019年7月份CDE新受理了 107 个(数据统计截至7月29日)仿制药一致性评价的申请,相比6月份增长近110%,这也是继2019年1月份后单月受理数首次突破三位数,猜想和7月中旬业界流传出国家医保局关于药品 4+7 集采扩面的消息不无关系。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57