2019年9月18日,罗氏宣布鉴于临床II期NOBILITY的积极结果,FAD授予其CD20抗体Gazyva突破性疗法认定,用于治疗成人狼疮性肾炎。NOBILITY数据显示,Gazyva与标准疗法联用可以增加患者一年内的完全肾反应。罗氏预计明年开展Gazyva的III期临床试验。
狼疮性肾炎是系统性红斑狼疮(SLE)的并发症,是因自身免疫系统攻击健康细胞和器官而导致的一种自身免疫性疾病,可能会危及生命。SLE患者中高达60%的患者会上狼疮性肾炎,且绝大多数患者为女性,其中25%狼疮性肾炎患者会患上终末期肾病。然而,目前FDA还未批准任何用于治疗狼疮性肾炎的药物。
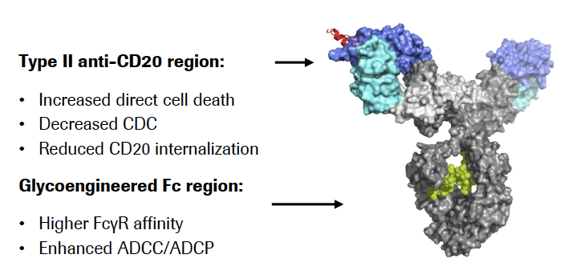
Gazyva(obinutuzumab)是罗氏旗下Genentech研发的CD20单抗,能够靶向结合B细胞表面的CD20,直接诱导B细胞死亡,发挥效力。Gazyva采用同时过表达GnTIII(N-乙酰葡萄糖胺基转移酶III)和ManII(高尔基α-甘露糖苷酶II)两个酶,通过空间位阴效应降低岩藻糖修饰,增强ADCC(抗体依赖的细胞**作用)作用,同时降低CDC(补体依赖的细胞**作用)作用,具有比美罗华(Rituxan)更佳的B细胞清除潜力。
Gazyva(obinutuzumab)
2013年11月1日,FDA批准Gazyva与苯丁酸**(Chlorambucil)联用治疗未经治疗的慢性淋巴细胞白血病(CLL),此后,Gazyva又先后获批与化药联用用于治疗滤泡型淋巴瘤(FL)和晚期FL,并与Imbruvica联用治疗CLL/小淋巴细胞淋巴瘤(SLL)。

最近研究发现,组织B细胞在狼疮性肾炎中扮演重要角色,清除组织B细胞对于治疗狼疮性肾炎很有必要,Gazyva在一项临床II期试验NOBILITY中验证了这一点。
2019年9月18日,基于II期临床NOBILITY的优异数据,FDA授予Gazyva治疗狼疮性肾炎突破性疗法认定。
NOBILITY(NCT02550652)是一项随机、双盲、安慰剂对照、多中心的临床II期试验,用于评估Gazyva与霉菌莫替普(MMF)或霉酚酸(MPA)联用,治疗成人ISN/RPS 2003 III类或IV类狼疮性肾炎的安全性和疗效,对照组为安慰剂与MMF或MPA联用。

NOBILITY试验设计
NOBILITY入组了126名患者,试验组和对照组在第1、15、168和182天分别接受治疗,试验主要终点是在52周时达到完全肾反应(CRR)的患者比例,次要终点为一年内实现全面肾反应(完全或部分肾反应)。
数据显示,NOBILITY试验取得主要终点和次要终点,与安慰剂 + MMF/MPA相比,患者采用Gazyva + MMF/MPA治疗一年内实现完全肾反应的效果更强,并且没有发现新的安全性问题,在不久后的会议上罗氏便会放出更完整详细的数据。
罗氏预计明年开展Gazyva治疗狼疮性肾炎的III期临床研究,目前FDA还未批准治疗狼疮性肾炎的药物,Gazyva有望填补这一空白。罗氏希望Gazyva可以接力Rituxan,复制Ocrevus和Hemlibra的成功,成为新的销售额增长点。
参考来源:
1.After touting Gazyva's potential in lupus, Roche nabs 'breakthrough' ahead of PhIII;
2.FDA Grants Breakthrough Therapy Designation for Genentech's Gazyva (Obinutuzumab) in Lupus Nephritis。
3.Roche官网
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57