
今年4月份,诺华为了加速brolucizumab用于治疗湿性年龄相关性黄斑变性(wet-AMD)的生物制品许可申请(BLA)使用了一张优先审评券,将brolucizumab的审查周期由常规的10个月缩短至6个月,预计10月份将得到FDA的回复。若brolucizumab顺利获批,将会成为继Pegaptanib、Lucentis、aflibercept之后FDA批准的第四款治疗wet-AMD的VEGF抑制剂药物,并且有望在今年年底进入市场,Evaluate Pharma曾预测其2024 年全球销售额有望达到 13.2 亿美元。
Brolucizumab是一款人源化单链抗体片段(scFv),分子量为26kDa,其片段体积小、渗透性强、对血管内皮生长因子VEGF-A异构体有强大的抑制作用及高度亲和力。此次诺华提交brolucizumab的BLA主要是基于两项名为HAWK和HARRIER的两项前瞻性、随机、双盲、多中心三期临床研究。这两项研究在从全球400个中心招募的1800名wet-AMD患者中开展,旨在比较玻璃体腔注射brolucizumab 6 mg和3 mg(仅HAWK试验)与aflibercept 2 mg相比在nAMD患者中的疗效和安全性, 试验中患者随机分配到brolucizumab组或aflibercept组,在3个月的装载期结束后,brolucizumab组患者会根据病情每12周或每8周用药一次,aflibercept组患者则每2个月用药一次。这两项研究的主要终点为brolucizumab对aflibercept的非劣效性,体现为矫正视力(BCVA)从基线到48周的平均变化。
这两项试验在48周时前瞻性地证明了使用创新的q12w/q8w给药方案的疗效,大多数患者在给药后会立即开始q12w方案。HAWK和HARRIER研究中分别有57%和52%的患者,在给药期后立即开始q12w方案可以维持至48周。这两项研究在48周时的数据表明:与aflibercept相比,brolucizumab达到了从基线到48周时矫正视力(BCVA)平均变化的非劣效性的主要疗效目标,且brolucizumab在nAMD疾病进展关键指标的三个次要终点--中央视野视网膜厚度、视网膜液(视网膜内液和/或视网膜下液)和疾病活动中显示出优势,与aflibercept组相比,brolucizumab(6mg)治疗组疾病活动的患者比例更低,且brolucizumab(6mg)治疗组视网膜液关键标志物显著减少。 96周时,brolucizumab 6 mg治疗组患者视网膜积液、中心视网膜厚度继续减少(降低),在BCVA中达到对aflibercept非劣效性的主要终点,再次证实了其48周的治疗结果(具体数据见下表)。
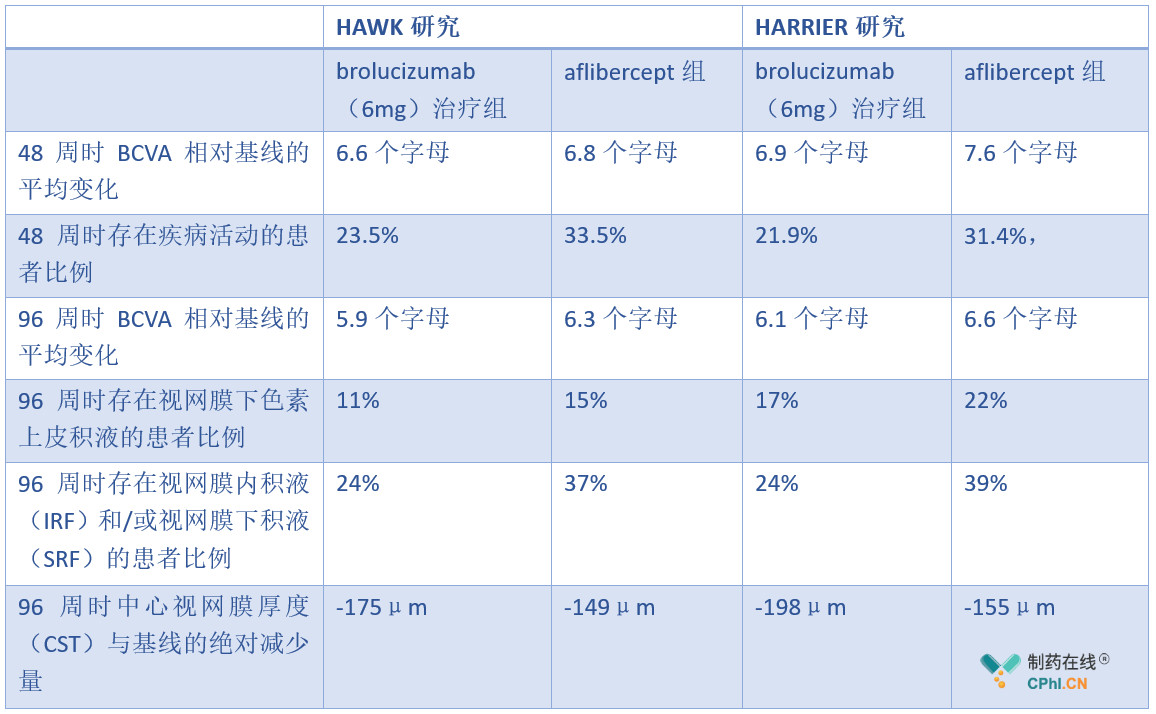
HAWK和HARRIER研究是在wet-AMD患者中前瞻性地证实brolucizumab以每12周一次(3个月一次)给药方案启动治疗表现出显著疗效的首批也是唯一一批全球性头对头临床研究。相信凭借在wet-AMD治疗领域方面的优势,brolucizumab有望迅速占领市场,瓜分其他VEGF抑制剂药物的市场份额。
关于wet-AMD及FDA批准的其他VEGF抑制剂药物
wet-AMD即湿性年龄相关性黄斑变性,又称新生血管性AMD(nAMD)是导致老年人出现严重视力丧失和失明的主要病因,在全球范围内大约影响了2000-2500万人群。如不及时治疗,两年内可以造成严重的视功能障碍。传统的治疗手段如激光光凝和光动力疗法等,虽能缓解病程的进展,但不可避免地会损害健康组织。随着眼底治疗方法的不断突破发展,血管内皮生长因子(VEGF)抑制剂药物应运而生,为治疗新wet-AMD开辟了新的方向,并成为大多数眼科医生治疗wet-AMD的首选药物。
在此之前,FDA批准治疗wet-AMD的VEGF抑制剂药物包括Eyetech制药公司和辉瑞公司共同研发的Pegaptanib sodium、罗氏旗下的基因泰克和诺华合作开发的Lucentis和再生元(Regeneron)的aflibercept(详见下表)。
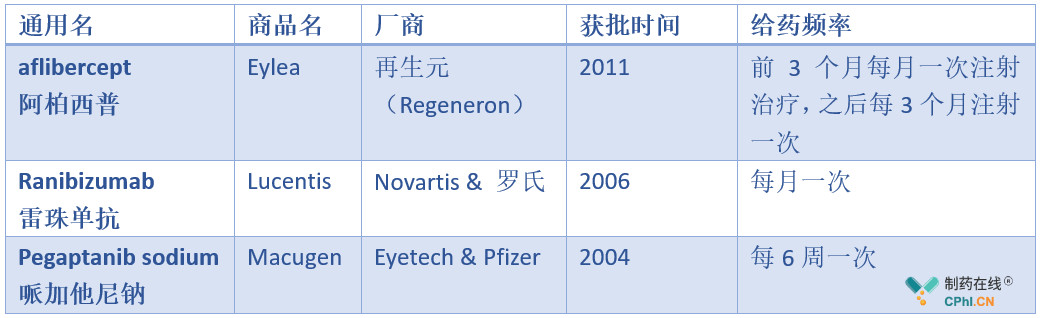
Pegaptanib是第一个用于治疗新生血管性眼病的VEGF抑制剂,作为一种化学合成的寡核苷酸序列,对血管内皮生长因子VEGF具有高度的亲和力,能够阻止血管生长,抑制新生血管形成。该药通过眼球玻璃体内注射,每次300ug,每6周一次,但连续注射两次后,疗效若不明显,就应考虑停止治疗。Pegaptanib sodium虽然上市最早,但由于其治疗效果有限市场表现不佳,为了提高其市场竞争力,其辅助用于治疗糖尿病性视网膜病的研究正在进行中。
Lucentis是一种人源化的治疗性抗体片段,是由罗氏旗下基因泰克和诺华合作开发,2006年在美国获批上市。Lucentis与Avastin(bevacizumab)作用机理一致,只是去掉了Fc段)Avastin是首个获批的抗VEGFA单抗,可超适应症用于眼科疾病)。经过十几年的创新,Lucentis凭借不仅能阻断疾病进程、还能提高或恢复患者视力这样优异的临床表现,已在全球110多个国家上市销售,用于治疗多达7个适应症:wet-AMD、糖尿病性黄斑水肿(DME)、视网膜分支静脉阻塞(BRVO)、视网膜中央静脉阻塞(CRVO)、病理性近视脉络膜新生血管(mCNV)、其他病因相关的CNV、早产儿视网膜病变(ROP)。而且诺华和罗氏正在继续探索Lucentis用于治疗最年轻、最脆弱患者群体的潜力。并于2011年在国内获批上市。2017年Lucentis全球销售额高达34.07亿美元,在全球药品销售额排行榜中排名第27,2018年Lucentis销售额高达37.19亿美元,在全球药品销售额排行榜中排名第23。
Eylea由再生元与拜耳合作开发,再生元拥有Eylea在美国的独家权利,拜耳拥有美国以外国家和地区的独家销售权。Eylea是一种重组融合蛋白,由人体VEFG受体1和2的胞外区与人体免疫球蛋白G1的可结晶片段融合而成,对VEGF-A、VEGF-B以及PlGF发挥着中和作用,而Lucentis仅为anti-VEGF-A抗体。目前在美国Eylea获批的适应症多达4个,包括:wet-AMD、视网膜静脉阻塞(RVO)继发黄斑水肿(ME)、糖尿病性黄斑水肿(DME)、糖尿病视网膜病变(DR)。而且Eylea也于2018年在国内获批用于治疗成人DME。Eylea凭借其使用的便利性,完胜lucentis,上市四年后就反超Lucentis,牢牢占据了通过抑制血管增生治疗眼底疾病的头把交椅。作为全球最畅销的产品之一,Eylea在2017年的全球销售额高达58.56亿美元,在全球药品销售额排行榜中排名第10,2018年全球销售额高达67.46亿美元,在全球药品销售额排行榜中排名第9。
从上面的销售数据可以看出,Eylea在VEFG抑制剂市场占有绝对优势。但是相信brolucizumab凭借药效长、疗效好、给药频率较低等优势,有望顺利获批并迅速抢占VEFG抑制剂在眼科疾病领域的市场,同时挑战Eylea在VEFG抑制剂市场的地位。除此之外,罗氏为了弥补Lucentis的不足,正在开发一种新的眼内给药系统ranibizumab PDS(雷珠单抗玻璃体植入物),这都将进一步加剧VEFG抑制剂在wet-AMD的市场之争。
参考资料:
[1] Regeneron Scores New Approval for Eylea Four Days After an FDA Rejection
[2] Novartis announces FDA filing acceptance and Priority Review of brolucizumab (RTH258) for patients with wet AMD



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57