2019年10月12日,Pfizer公布其治疗特应性皮炎的JAK1抑制剂Abrocitinib的全部III期临床(JADE MONO-1)数据,达到所有主要复合终点和关键次要终点,两种剂量的Abrocitinib均具有良好的耐受性和安全性。Pfizer下一个三期临床试验以Dupixent为对照组,预计2020年上市Abrocitinib,挑战Dupixent的市场地位。
特应性皮炎(atopic dermatitis,AD)是一种严重的慢性炎症性皮肤病,主要表现为剧烈的瘙痒、明显的湿疹样变和皮肤干燥,常常自婴幼儿发病,部分患者延续终生。特应性皮炎影响全球1%~10%成人以及15%~20%的儿童。抑制JAK1信号通路可以调控多条与AD发病机制相关的信号通路,包括IL-4、IL-13、IL-31和干扰素γ,是AD药物研发的思路。
Abrocitinib(PF-04965842)是Pifzer研发的一款口服小分子高选择性JAK1抑制剂,2018年2月获得FDA授予的治疗中重度特应性皮炎的突破性药物资格,其有望成为Pifzer计划在2022年前上市的重磅 炸 弹。
2019年10月12日,Pifzer公布了Abrocitinib治疗中重度特应性皮炎III期临床试验JADE MONO-1的全部数据,试验达到了所有主要复合终点和关键次要终点,安全性和药物耐受性数据良好。
JADE MONO-1是一项双盲、平行组设计的III期试验,入组387名中重度(IGA=3和IGA=4)的成年和青少年特应性皮炎患者,按1:1:1随机接受200mg Abrocitinib、100mg Abrocitinib和安慰剂治疗,用于评估Abrocitinib的疗效和安全性。
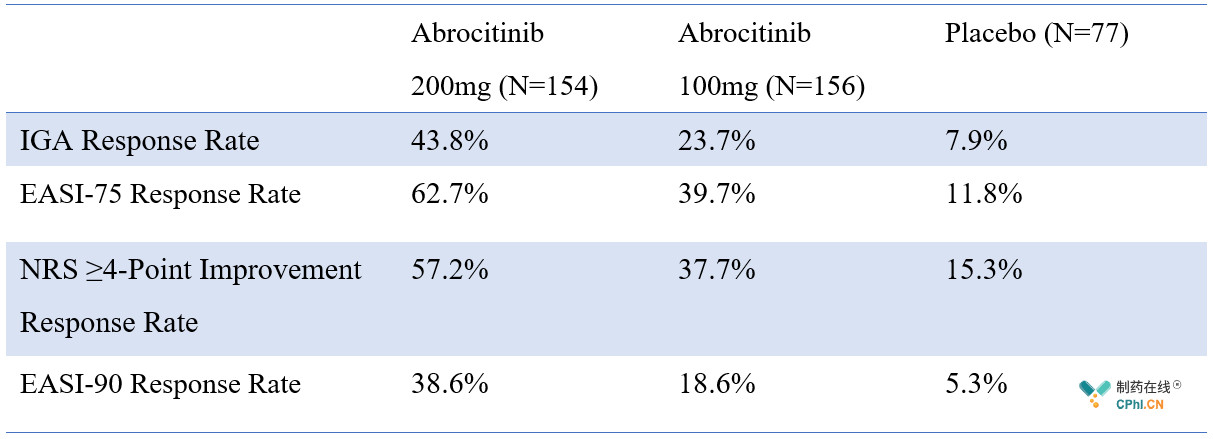
JADE MONO-1的主要复合终点包括:1)患者研究者总体(IGA)评分为0或1及IGA评分基于基线改善≥2的患者比例;2)湿疹面积和严重程度指数(EASI)评分较基线改善75%以上的患者比例。关键次要终点包括使用瘙痒数值评分量表(NRS)评估的瘙痒严重程度缓解4分以上的患者比例,以及特应性皮炎瘙痒及症状评估(PSAAD)显著减轻的患者比例。
数据显示,与安慰剂相比,两种不同剂量的Abrocitinib显著提高了IGA和EASI-75患者应答率,具体疗效数据见下表。
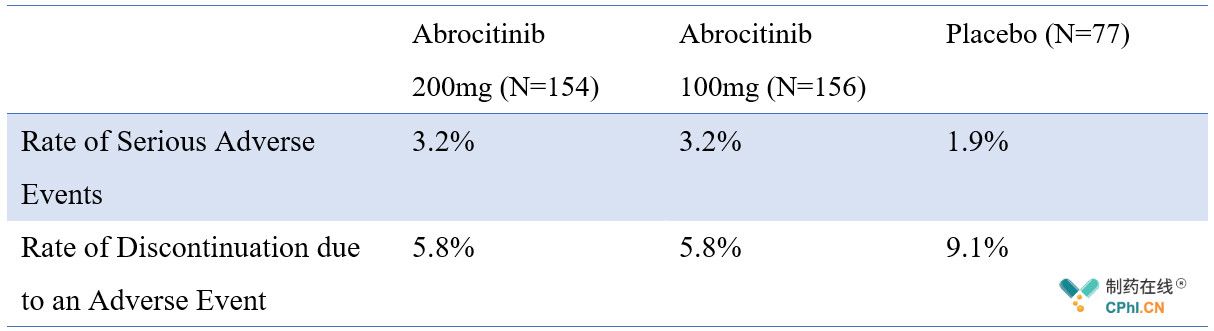
JADE MONO-1试验中常见的与Abrocitinib相关的副作用包括:短期的恶心(200mg 和100mg剂量对应的比例分别为20.1%和9.0%)、头痛(9.7%,7.7%)和鼻咽炎(11.7%,14.7%),安慰剂组为皮炎(16.9%)。200mg Abrocitinib发现两例严重副作用(炎性肠病、扁桃体周炎、脱水和哮喘),100mg Abrocitinib组的严重副作用包括视网膜脱离、急性胰 腺炎、阑尾炎和眩晕,安慰剂组的严重副作用包括病情恶化、阑尾炎、半月板变性和特应性皮炎,其他安全性数据见下表。
在Abrocitinib的下一个III期临床试验(NCT03720470)中,Pfizer将Abrocitinib和Dupixent(dupilumab)进行比较,预计2020年年初获得临床结果,随后Abrocitinib将会申请上市。
Dupixent是Sanofi和Regeneron研发的特应性皮炎IL-4Rα抗体,2017年3月29日获得FDA批准治疗成人难治性中重度特应性皮炎,是FDA批准的首个治疗中重度特应性皮炎的生物制品,2019年3月将适应群体扩展到青少年患者。
2018年Dupixent的销售额达9.22亿美元,面对巨大的特应性皮炎市场,Abrocitinib也想要从中分一杯羹,III期临床数据表明Abrocitinib确实具有这样的底气。
简单回顾Dupixent的III期临床数据,治疗16周后,IGA评分为0或1的患者比例在36%-39%之间,EASI评分改善57%以上的患者比例在44%-69%之间。虽然Dupixent和Abrocitinib的III期临床数据交叉比较的可靠性低,但还是可以看出Abrocitinib是具有竞争力的。

再看Abrocitinib的次要终点,瘙痒是影响特应性皮炎患者的重要因素,JADE MONO-1试验中,200mg Abrocitinib患者组NRS评分缓解4分以上的患者比例达57.2%,而此项Dupixent的数据分别为36%、41%和59%。
用药便利性上,Dupixent为注射给药,而Abrocitinib为口服给药,更为便捷。
Pfizer预计2020年递交Abrocitinib的上市申请,并有望当年获得批准,预祝Abrocitinib为特应性皮炎患者带来更加有效便捷的疗法。
参考来源:
1. Pfizer posts detailed phase 3 data on its Dupixent rival;
2. PFIZER PRESENTS POSITIVE PHASE 3 DATA AT THE 28TH CONGRESS OF THE EUROPEAN ACADEMY OF DERMATOLOGY AND VENEREOLOGY FOR ABROCITINIB IN MODERATE TO SEVERE ATOPIC DERMATITIS
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57