2019年10月22日,Biogen重新分析阿尔茨海默病新药Aducanumab的两项III期临床试验EMERGE和ENGAGE大数据集后,宣布EMERGE试验达到主要终点,高剂量Aducanumab可使患者认知能力衰退减少23%(p=0.01)。
此外,基于与FDA就Aducanumab临床试验大数据集的讨论,Biogen预计明年年初递交Aducanumab上市申请,如果获批,Aducanumab将成为β-淀粉样蛋白假说最好的佐证,也会是首款降低阿尔茨海默病患者认知能力衰退的新药。
阿尔茨海默病(Alzheimer's disease,AD),又称老年痴呆症,是与癌症具有同等威胁的疾病,然而学者对其发病机制还没有明确的认定,β-淀粉样蛋白(Aβ)假说被认为是最主流的成因。围绕Aβ假说,人们做了大量研究,也栽了很多跟头。
2019年3月21日,Biogen和Eisai宣布终止其AD药物Aducanumab的两项III期临床试验(ENGAGE和EMERGE),数据监测委员会发现Aducanumab对于由AD引起的轻度认知功能损伤没有改善作用,很难抵达主要终点。
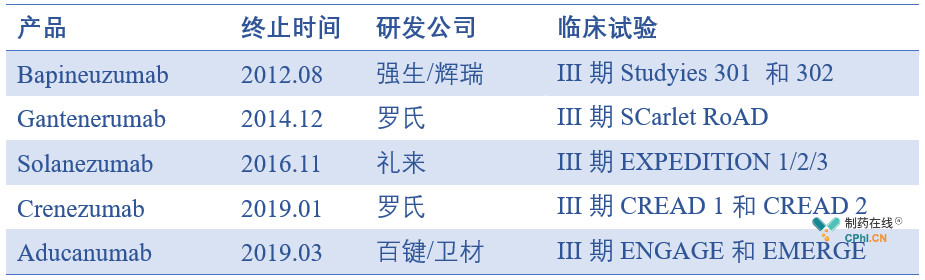
Aducanumab的失败并不是那么突兀,毕竟过去的15年里,99%的AD临床试验都失败了,如Bapineuzumab(2012)、Gantenerumab(2014)、Solanezumab(2016)、Crenezumab(2019)。
抗Aβ阿尔茨海默病新药开发的失败案例
近日,已宣布退出阿尔茨海默病的Aducanumab似乎出现转机。
2019年10月22日,Biogen结合更大的数据集重新分析了Aducanumab的两项III期临床试验EMERGE和ENGAGE,否定了今年3月份两项III期临床数据无效性的决定,并且根据最新的分析结果宣布EMERGE达到主要终点,ENGAGE依旧无缘主要终点,当日Biogen股价大涨40%!
根据最新的数据分析结果,高剂量Aducanumab可使患者认知能力衰退减少23%(p=0.01),有效提高患者的记忆、方向和语言等认知能力,改善患者清洁、购物、洗衣和独自外出等日常生活能力。
造成相同临床试验不同分析结果的主要原因是,3月份数据无效性是依据2018年12月得到的数据,数据量少且患者接受高剂量Aducanumab的时间短,而最新的数据结果来源于更大的数据集(截止到2019年3月)且患者更充分的暴露于高剂量Aducanumab,具体数据来源区别见下图。
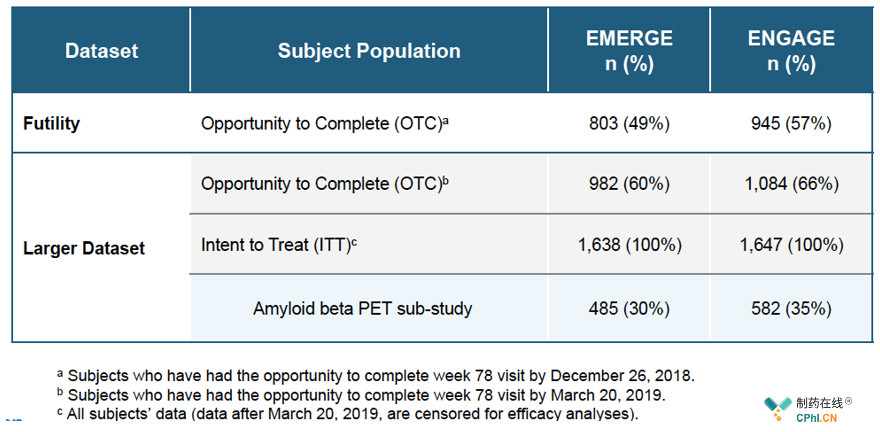
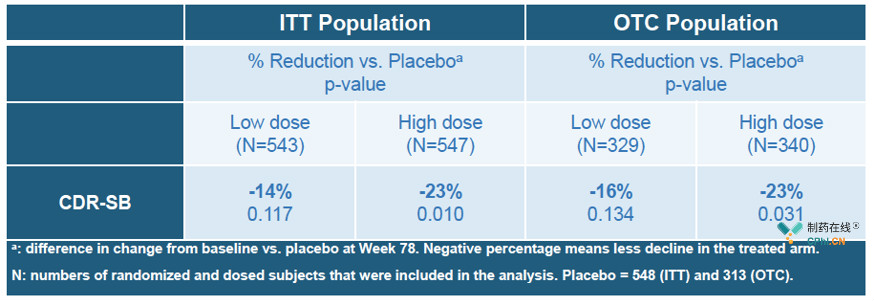
根据Biogen对大数据集的分析,EMERGE试验中高剂量Aducanumab达到主要终点和次要终点,临床痴呆评定量表(CDR-SB)分数降低23%(p=0.01),简易**量表(MMSE)分数降低15%(p=0.062),AD评定量表认知部分(ADAS-cog)分数降低27%(p=0.01),而ENGAGE试验中无论是低剂量还是高剂量都没有达到主要终点或次要终点。
EMERGE主要终点:
EMERGE次要终点:
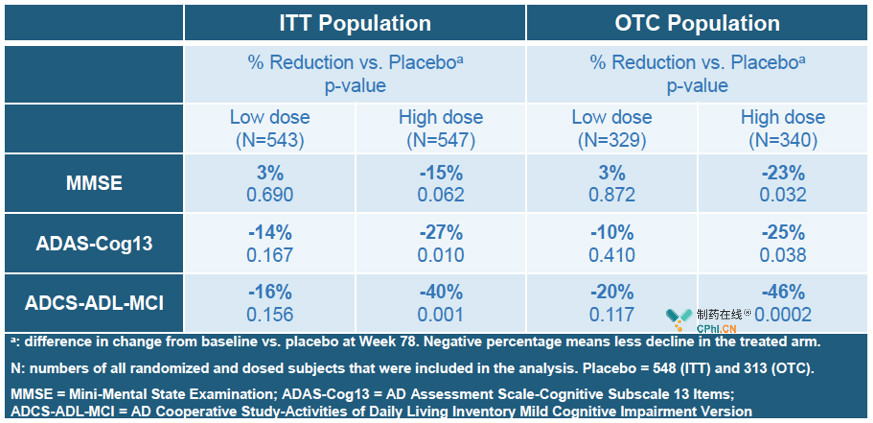
ENGAGE主要终点和次要终点:
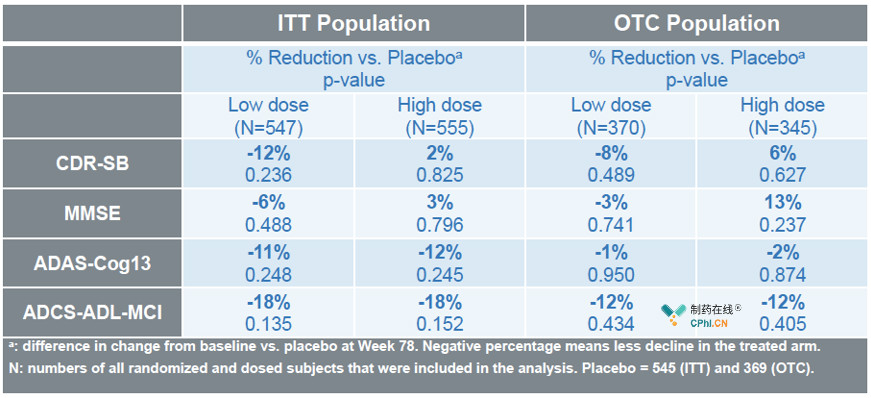
也有人质疑Biogen,为什么EMERGE和ENGAGE数据具有这样的差异?Biogen认为造成这种差异的原因是,EMERGE临床试验中接受高剂量Aducanumab的患者比例高且时间长。
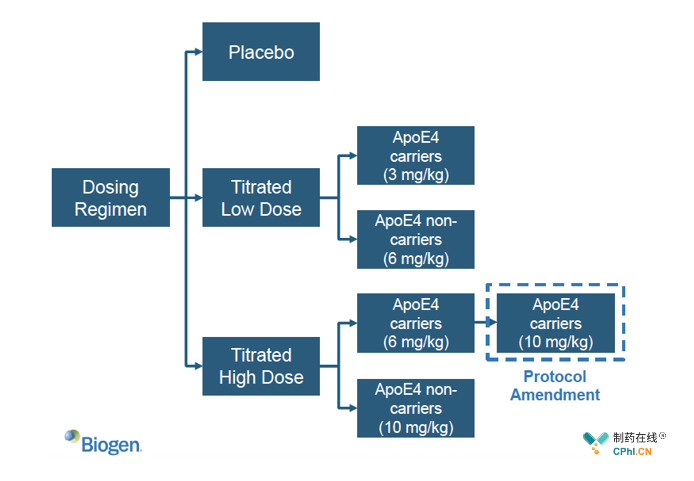
III期临床试验EMERGE和ENGAGE都包含高低两种Aducanumab剂量,低剂量组为3 mg/kg和6 mg/kg,高剂量组为6 mg/kg和10 mg/kg。ENGAGE先入组患者,EMERGE后入组患者,患者筛选过程中Biogen对高剂量组进行一次修正,改为10 mg/kg和10 mg/kg,这就造成两项临床试验中接受高剂量Aducanumab治疗的患者数量和时间不同,进而影响试验结果。
Biogen对于EMERGE临床试验数据重新分析的结果很满意,外界对于这样的分析结果存在很多质疑,另外在ENGAGE数据中还展现出更不好的迹象(CDR-SB和MMSE),对于这些质疑Biogen将在今年年底展现详细数据。
Biogen和外部顾问及FDA讨论后,表示有信心让Aducanumab上市销售,并将于2020年年初向FDA递交上市申请。
现在的问题是FDA会不会同意Aducanumab上市?从近来上市的新药来看,FDA会倾向于同意针对未满足医疗需求的新药上市,阿尔茨海默病就属于这一类。然而,一般情况下需要两项III期试验的积极结果才能通过FDA审批,Aducanumab两项III期临床试验,一项成功,一项失败,这样的数据能否说服FDA?
如果获批,Aducanumab将成为首款治疗阿尔茨海默病的新药,也会成为β-淀粉样蛋白假说最好的佐证,激励更多药企再次投入到抗β-淀粉样蛋白抗体的研发中。
参考来源:
1.Biogen resurrects aducanumab, arguing expanded data set supports FDA filing in Alzheimer's
2.In a stunning turnaround, Biogen says that aducanumab does work for Alzheimer's - and they're prepping a pitch to the FDA
3.Biogen官网
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57