承办情况
据中国药品审评数据库2.0统计,2019年CDE共承办仿制申请1051件(含进口5.2类),涉及395个品种,同比增长7.24%,增幅有所放缓。随着药品集中采购继续推进,普通仿制药将进入微利时代,企业在进行仿制药立项时将更加谨慎。
2016-2019年CDE承办仿制药申请情况(按受理号)
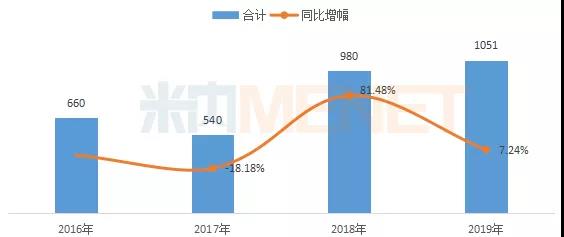
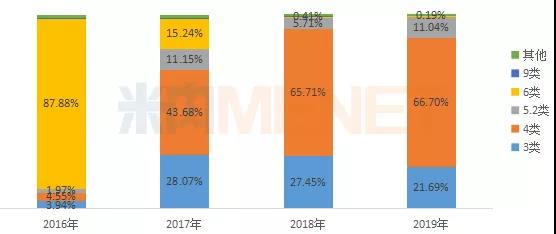
从注册分类看,进口5.2类的仿制申请在2019年有所回升,按新3类和新4类的仿制申请占比已趋于稳定。
2016-2019年仿制申请注册分类占比变化情况
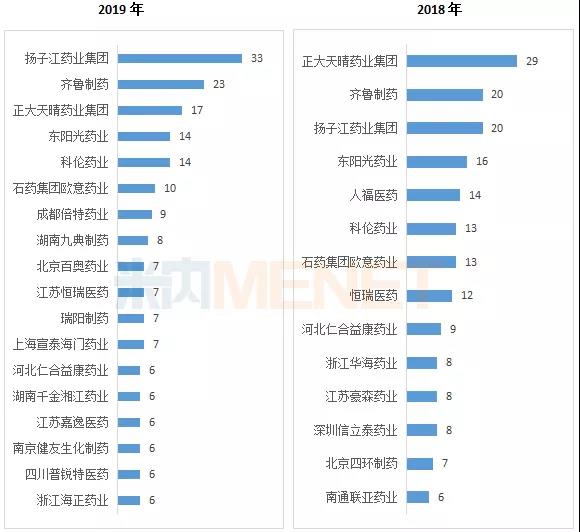
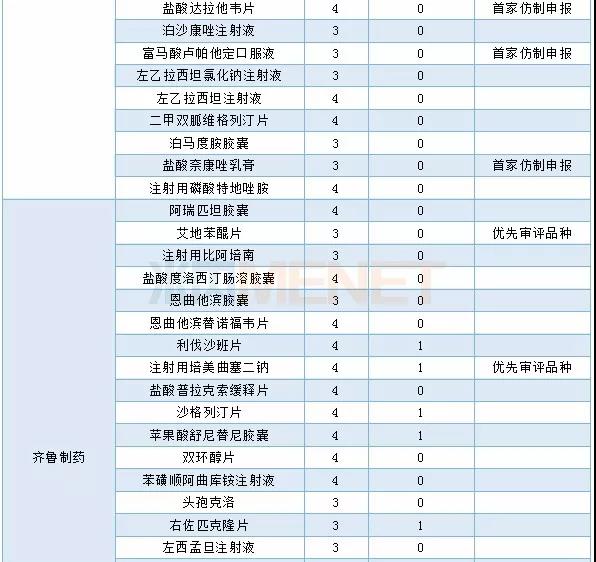
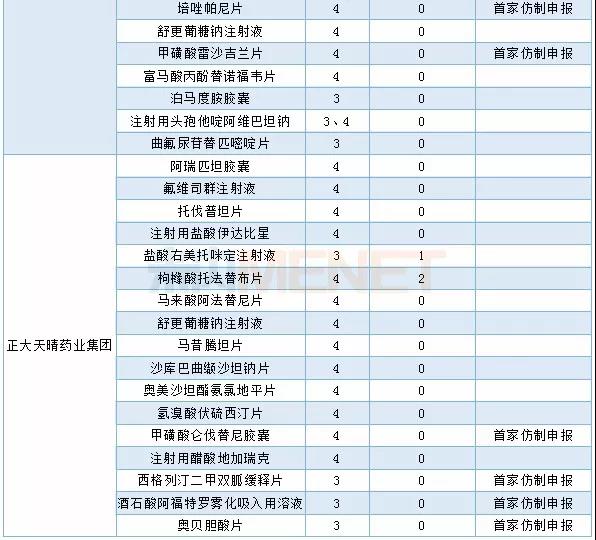
2019年仿制药申报品种数超过6个的企业有18个,其中以扬子江药业集团仿制药申报最为活跃,正大天晴药业集团在2019年申报了17个仿制药,比2018年减少近一半。在药品集中采购的影响下,不少企业把仿制药研发转向具有高技术壁垒的高端仿制药,仿制药的研发格局将面临重构。
2018-2019年主要企业仿制药申报情况(按品种名称)
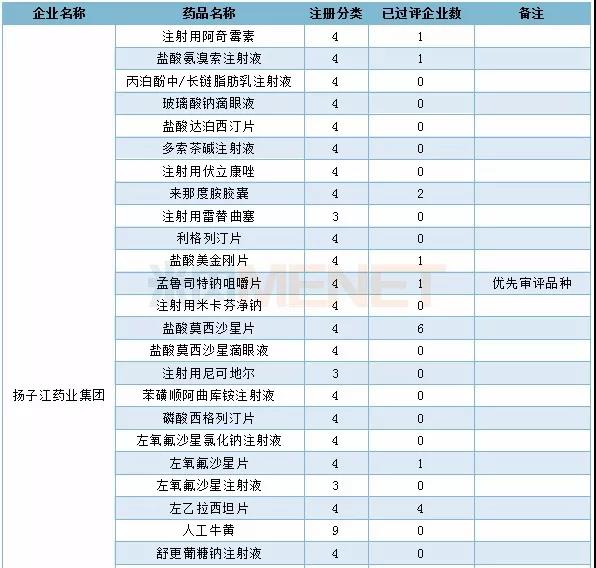
2019年仿制申请TOP3企业具体申报情况
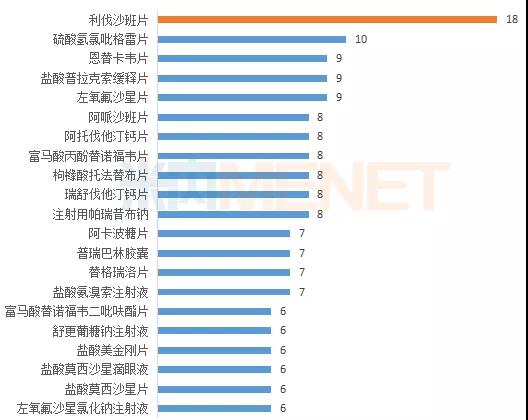
2019年仿制申报企业数超过6家的品种有21个,其中利伐沙班片的仿制申请企业最多,有18家企业。其次是硫酸氢氯吡格雷片有10家,左氧氟沙星片、盐酸普拉克索缓释片以及恩替卡韦片均有9家企业申报。
2019年主要品种企业申报情况
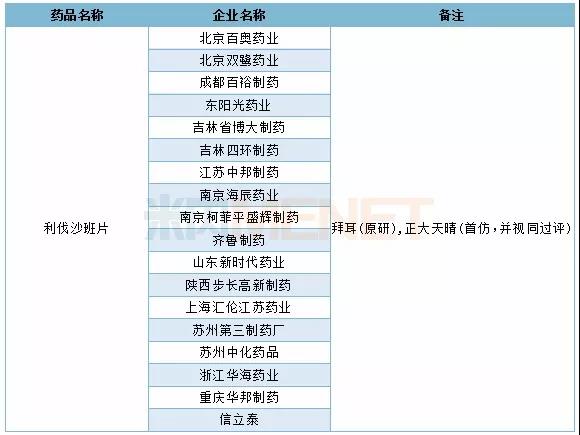
2019年利伐沙班片具体申报企业情况
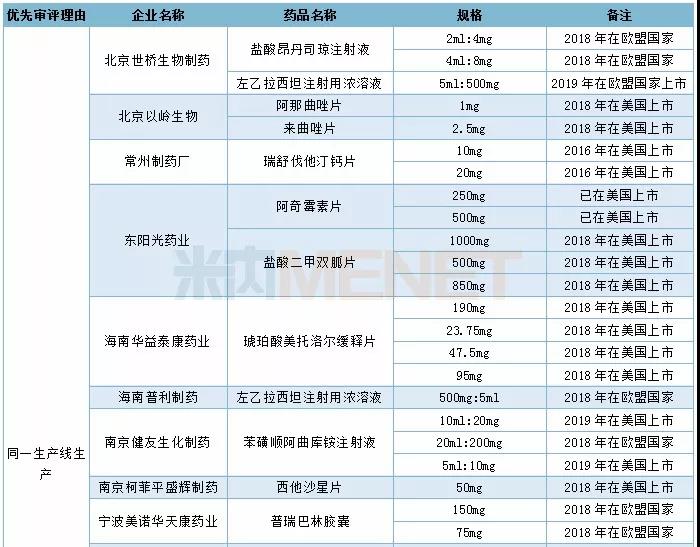
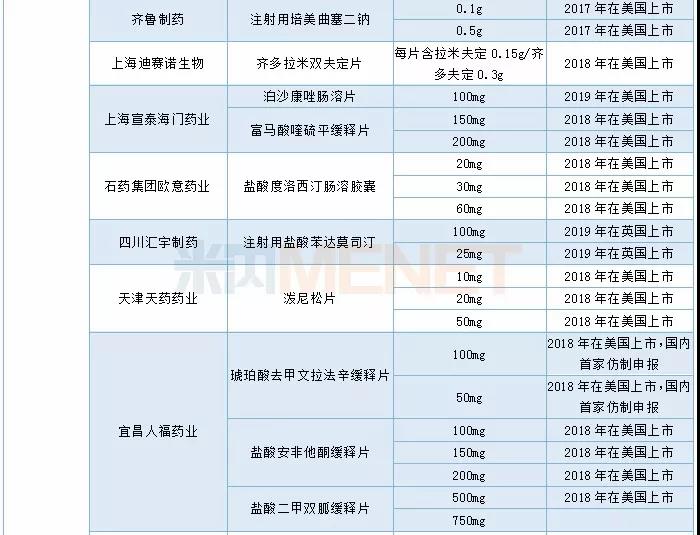
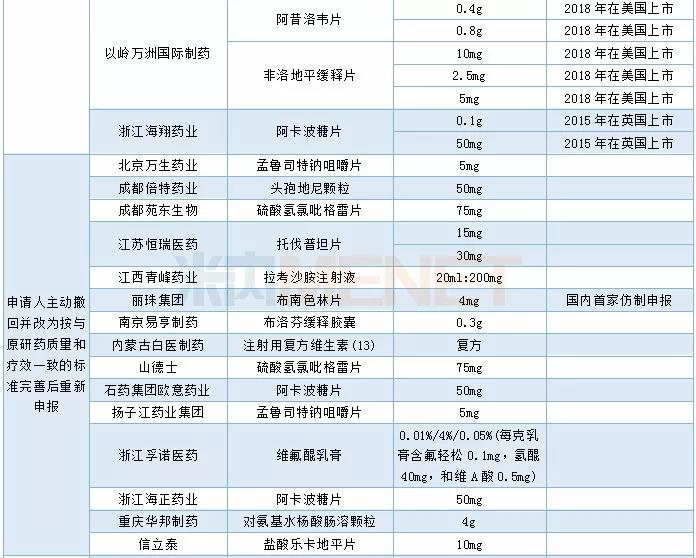
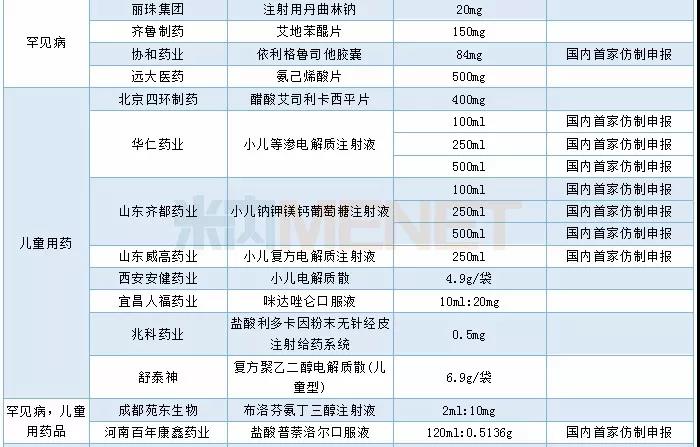
2019年CDE承办的仿制药中有54个品种被正式纳入优先审评,其中同一生产线生产的品种最多,有24个。从企业角度看,宜昌人福药业共有4个品种被纳入优先审评(3个同一生产线,1个儿童用药)。
2019年CDE承办仿制药纳入优先审评情况
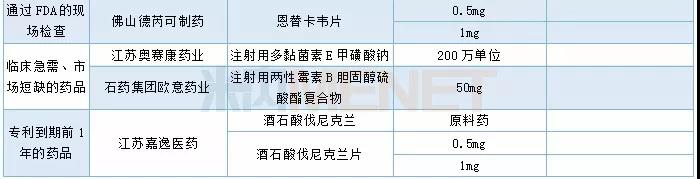
获批情况
2019年按新注册分类申报的仿制申请进入了密集收获期。2019年NMPA共批出140个按新注册分类申报的仿制药批文(含按新分类标准审评的旧6类仿制申请),涉及67个品种。其中有27个品种(40个批文)为国内首仿。
2017-2019年新注册分类仿制药获批情况(按批准文号)
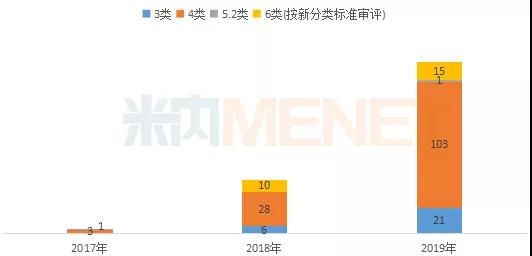
(按NMPA批准日期统计)
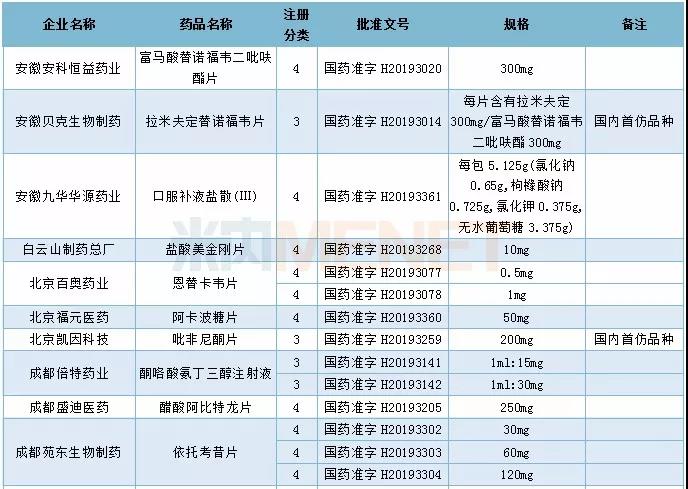
2019年新注册分类仿制药获批具体情况



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57