2020年1月份,FDA共批准了3款新药,分别为Ayvakit、Tepezza和Tazverik,本文对这3款新药进行了概述。
2020年1月份FDA批准的3款新药
Ayvakit(avapritinib)

2020年1月9日,Blueprint Medicines宣布FDA批准其新药Ayvakit(avapritinib)上市,用于治疗携带血小板衍生生长因子受体α(PDGFRA)基因18号外显子突变(包括PDGFRA D842V突变)的不可切除性或转移性胃肠道间质瘤(GIST)成人患者。Ayvakit是首款被批准用于GIST的精准疗法,也是唯一一款对PDGFRA基因18号外显子突变型GIST具有高活性的药物。
Ayvakit(图片来源于PubChem)
GIST是一种罕见的由基因组驱动的胃肠道肉瘤,约6%的新诊断GIST患者具有PDGFRA外显子18突变,其中最常见的PDGFRA外显子18突变是D842V突变,而其对所有其他已批准的疗法都具有耐药性。
Ayvakit(avapritinib)可选择性和强效地抑制KIT和PDGFRA突变激酶。已经证实,Ayvakit对GIST相关的KIT和PDGFRA突变具有广泛的抑制作用,还对耐药相关的loop突变活性具有抑制性。Ayvakit对KIT和PDGFRA的选择性明显高于其他已批准的多激酶抑制剂。
临床I期试验NAVIGATOR为FDA批准Ayvakit提供了数据支持。NAVIGATOR临床结果显示,在携带PDGFRA外显子18突变的GIST患者中,接受Ayvakit治疗后,达到84%的总缓解率(95 CI: 69%,93%),7%的患者完全缓解,中位缓解持续时间(DOR)尚未达到。
另外,Blueprint表示,FDA还在进行Ayvakit作为4线疗法治疗GIST的新药审评工作,预计PDUFA日期为5月14日。
Tepezza(teprotumumab-trbw)

2020年1月21日,Horizon Therapeutics宣布FDA批准其创新疗法Tepezza(teprotumumab-trbw)上市,用于治疗甲状腺眼病,Tepezza是这一罕见眼病的首款获批疗法!
甲状腺眼病(Thyroid Eye Disease,TED),又称Graves'眼病(GO),是一种严重的、进行性的、威胁视力的自身免疫性疾病,该疾病经历最多三年的活跃期后会进入稳定期,长发病于患有甲状腺功能亢进症或Graves'患者群中。
活跃期TED主要表现为眼球后部炎症和组织增生,随着疾病进展会导致眼球突出、斜视、复视、甚至失明等严重后果。仅活跃期TED可使用皮质激素类药物部分缓解病情,FDA还未批准针对性疗法。TED转入稳定期后,炎症会消退,而增生组织不会,患者往往只能接受眼部手术。
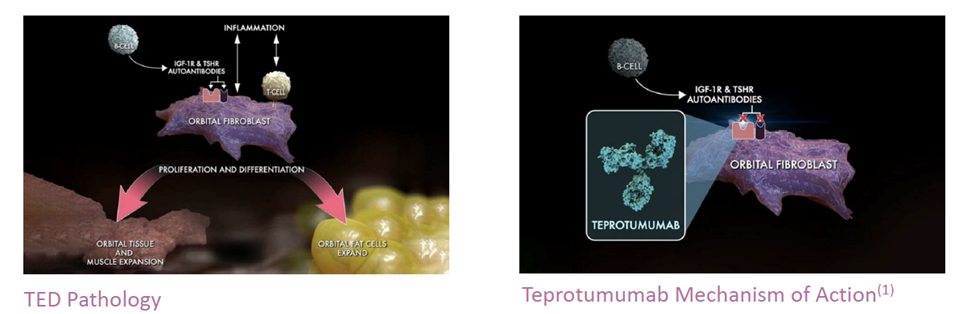
Tepezza是Horizon Therapeutics研发的IGF-1R全人源单克隆抗体,可阻断IGF-1R,致使患者眼部细胞内的IGF-1和促甲状腺激素(TSH)活跃水平降低。IGF-1R和促甲状腺激素受体(TSHR)在TED患者眼眶成纤维细胞中水平偏高,两者之间存在着复杂的信号通路网络联系,与疾病发生密切相关。FDA已授予Tepezza治疗活动性TED的突破性药物资格、孤儿药资格、快速通道资格、优先审查资格。
此次Tepezza获批日期要比原定的PDUFA(2020-03-08)提前一个多月,FDA根据一项临床II期试验和III期临床OPTIC对Tepezza进行了审评和批准。OPTIC数据显示,治疗第24周时,Tepezza组有82.9%的患者达到眼球突出或鼓胀相对基线减少≥2 mm,而安慰剂组为9.5%,具有统计学显著差异(p<0.001)。此外,Tepezza也达到了所有次要终点,未发现新的不良事件。
Horizon预计近期在美国销售Tepezza,为TED患者一种新疗法,缓解活跃期TED患者症状及疾病进展,减少眼球突出。
Tazverik(tazemetostat)

2020年1月23日,Epizyme宣布FDA加速批准其表观遗传学药物Tazverik(tazemetostat)上市,用于治疗16岁及以上、不符合完全切除条件的转移性或局部晚期上皮样肉瘤儿科和成人患者。
上皮样肉瘤(ES)是一种罕见的软组织肉瘤,在所有软组织肉瘤中占比不到百分之一,往往发生在青年人身上。大多数上皮样肉瘤病例开始于肢体皮肤下的软组织,主要的治疗方法是手术切除、化疗或放疗。即使经过治疗,这种疾病转移的可能性也很高,大约50%的患者会发生转移,转移的患者生存期不到一年。

Tazverik是一种口服、强效、首创的EZH2抑制剂。EZH2是一种组蛋白甲基转移酶,如被异常激活,将导致控制细胞增殖的基因失调,从而可引起非霍奇金淋巴瘤(NHL)及其他多种实体瘤细胞的无限制迅速生长。Tazverik可通过抑制EZH2酶活性而发挥抗肿瘤作用。
基于II期临床试验Study EZH-202(NCT02601950),FDA批准了Tazverik的上市申请。该II期研究入选了62名转移性或局部晚期上皮样肉瘤患者,每日两次接受Tazverik 800 mg口服给药,直至疾病进展或出现不可接受的**。研究结果显示,接受治疗的62名患者中,总缓解率为15%,1.6%的患者达到完全缓解,13%的患者达到部分缓解。
Tazverik是FDA批准的首款也是唯一一款EZH2抑制剂,也是首款及唯一一款专门针对ES患者的疗法。Tazverik的加速批准,对ES患者群体来说是一个里程碑式的事件。
参考来源:FDA/Blueprint/Horizon/Epizyme官网
作者简介:知行,用简单的语言讲述不简单的未来,一个不断前行的医药人。
点击下图进行CPhI & P-MEC China 2020观众预登记,立省100元观展门票!



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57