4 月 19 日,据美国 FDA 官网信息,上海复星医药(集团)有限公司(简称复星医药)已收到 FDA 对其 COVID-19 RT-PCR 检测试剂盒的紧急使用授权(EUA)。

该检测试剂盒由复星医药全资子公司复星长征自主研发,目前已获得国家医药产品监督管理局(NMPA)颁发的医疗器械注册证书(注册证编号:国械注准20203400299)和欧盟(EU)颁发的 CE 认证。
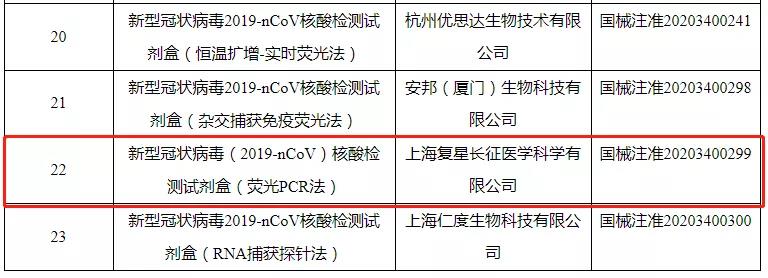
该试剂盒可实现特异性 ORF1ab、N、E 基因靶向的新型冠状病毒 RNA 的定性检测,并具备全自动操作优势,可在 2 小时内完成 96 份样品的检测。此外,自动化操作将降低操作人员感染的风险,减少实验室交叉污染的风险,提高检测效率。
复星医药的业务覆盖整个医疗保健产业链,以医药制造和研发部门为核心业务,包括医疗器械和诊断、医疗保健服务以及医药分销和零售。
公司 2019 年财报显示,复星医药的营收较 2018 年增长了 14.72%,达到 285.85 亿元人民币。其中,医疗器械和医疗诊断板块 2019 年实现良好增长,实现营业收入 37.36 亿元,较 2018 年同比增长 2.66%,同口径增长 28.52%(考虑「达芬奇手术机器人」代理业务转入合资公司直观复星等因素)。



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57