2020年04月,全球首次批准新药主要集中在美国和俄罗斯。美国食品药品监督管理局(FDA)批准了3个新分子实体(NME),分别是:用于治疗神经纤维瘤的Selumetinib,用于治疗乳腺癌的Tucatinib,用于治疗胆管癌的Pemigatinib。此外,FDA批准新生物制品2个,分别是:用于治疗三阴性乳腺癌的Sacituzumab govitecan,用于治疗A型、B型血友病的Coagulation factor VIIa (recombinant)-jncw。俄罗斯卫生部批准单克隆抗体1个:用于治疗黑色素瘤的Prolgolimab。
表1. 2020年04月新分子实体(NME)及生物制品批准情况
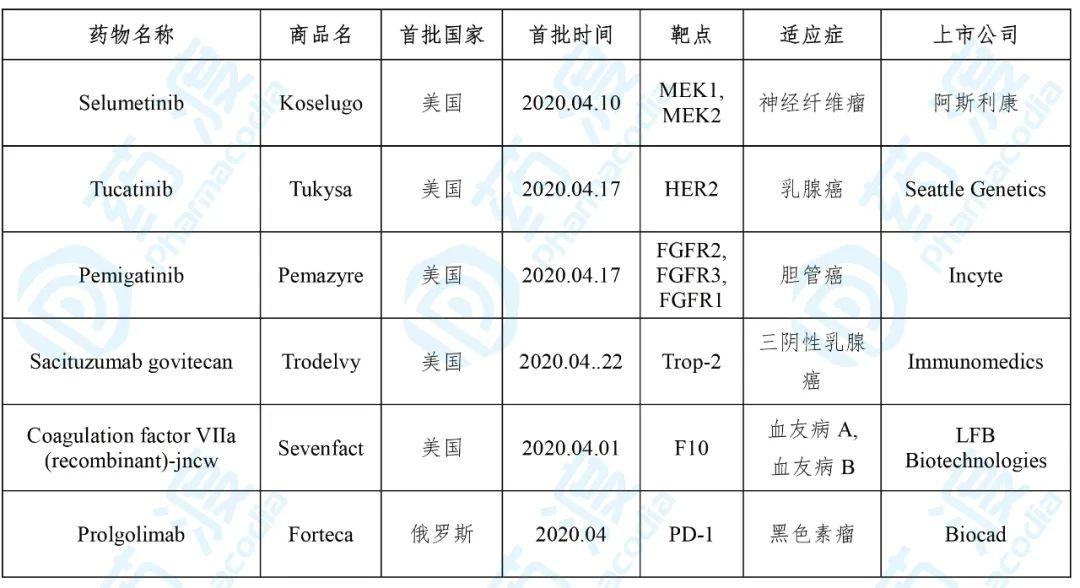
数据来源:药渡数据
1. Selumetinib
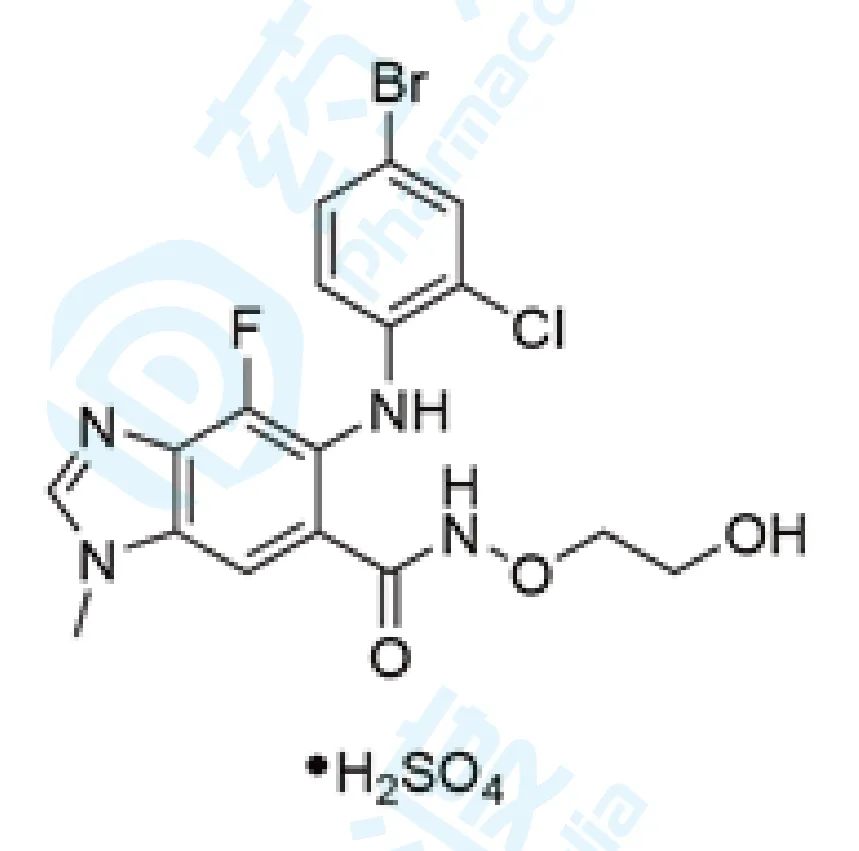
Selumetinib最初由Array BioPharma研发,2013年其全球开发权被授予阿斯利康,并于2020年04月10日获得FDA批准上市,商品名为Koselugo® ,用于2岁以上伴有不能手术的丛状神经纤维瘤(PN)的1型神经纤维瘤(NF1)儿童患者的治疗 [1] 。
1型神经纤维瘤又被称为Von Recklinghausen病,是由神经嵴细胞分化异常导致多系统损坏的一种常染色体显性遗传病,其发病与17号染色体上的NF1基因突变有关 [2] 。
表2. Selumetinib同适应症药物
数据来源:药渡数据
Selumetinib是丝裂原活化蛋白激酶1和2(MEK1/2)的抑制剂。MEK1/2蛋白是细胞外信号相关激酶(ERK)通路的上游调节因子,MEK和ERK都是RAS调控的RAF-MEK-ERK通路的重要组成部分,这一通路常在多种癌症中被激活 [3] 。
Koselugo® 的获批是基于一项针对1型神经纤维瘤患者的多中心开放性单臂临床试验。主要治疗指标总有效率(定义为目标PN消失或者3-6个月内PN体积减少超过20%的患者比例)为44% [3] 。
Selumetinib是FDA批准的首个治疗1型神经纤维瘤的药物,并于2015年和2018年分别获得FDA和欧洲药品管理局(EMA)授予的治疗1型神经纤维瘤的孤儿药资格。
2. Tucatinib
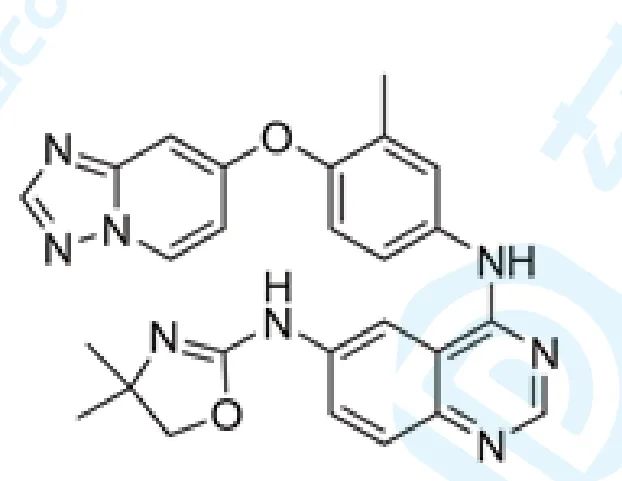
Tucatinib由Seattle Genetics开发,于2020年4月17日获得FDA批准上市,商品名为Tukysa® ,用于与曲妥珠单抗和卡培他滨联合治疗患有晚期无法切除或转移性HER2阳性乳腺癌患者 [4] 。
Tucatinib是HER2的酪氨酸激酶抑制剂。在体外实验中,Tucatinib能抑制HER2和HER3的磷酸化,从而抑制下游MAPK和AKT信号传导及细胞增殖,并对存在HER2表达的肿瘤细胞中显示出抗肿瘤活性。在体内实验中,Tucatinib也显示出对存在HER2表达的肿瘤细胞的抑制作用,且其与曲妥珠单抗联合使用显示出超过单独使用两种药的抗肿瘤活性 [5] 。
表3. 2010年以来上市的Tucatinib同靶点药物
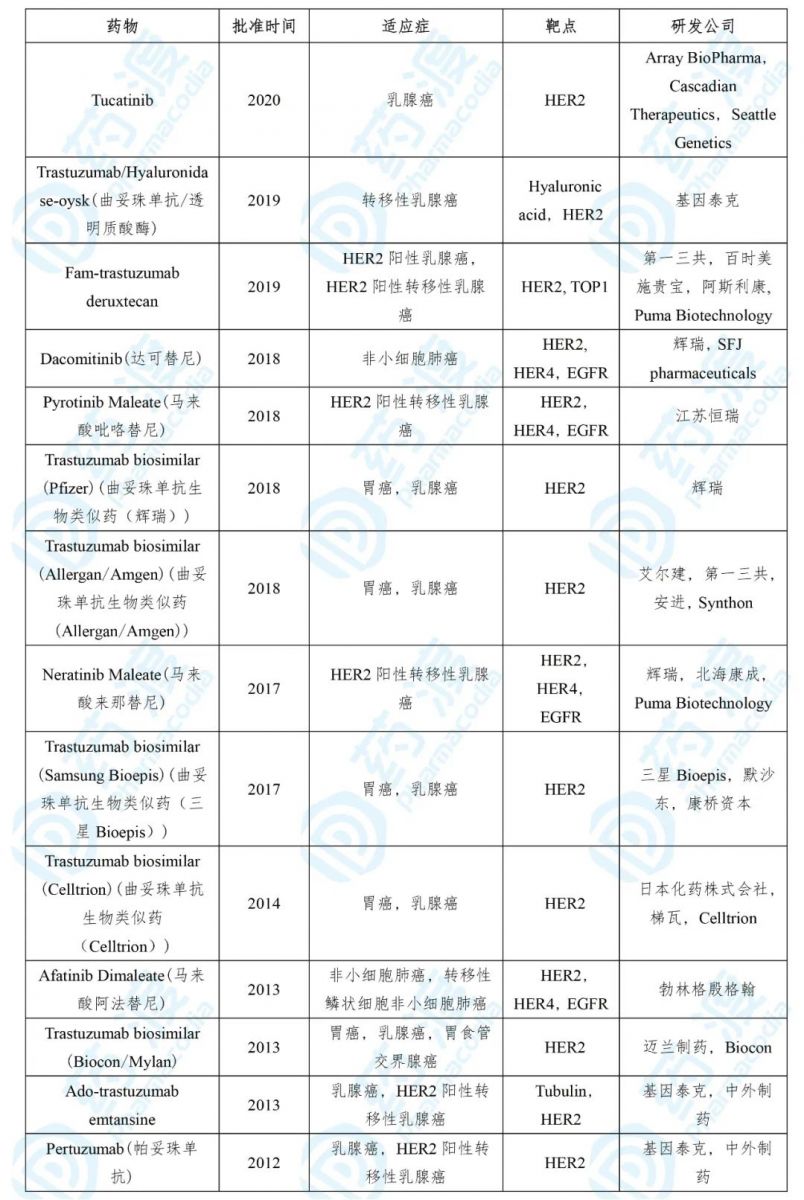
数据来源:药渡数据
Tukysa® 的获批是基于一项针对HER2阳性转移性乳腺癌患者的随机、双盲、安慰剂对照实验。实验对Tucatinib与曲妥珠单抗和卡培他滨联合治疗的疗效进行了评价,Tucatinib联合治疗患者FPS指标的事件出现率为56%,时间中位数为7.8个月,危险比为0.54(与安慰剂组相比);OS指标的死亡率为32%,时间中位数为21.9个月,危险比为0.66(与安慰剂组相比);ORR为40.6%(高于安慰剂组的22.8%) [5] 。
3. Pemigatinib
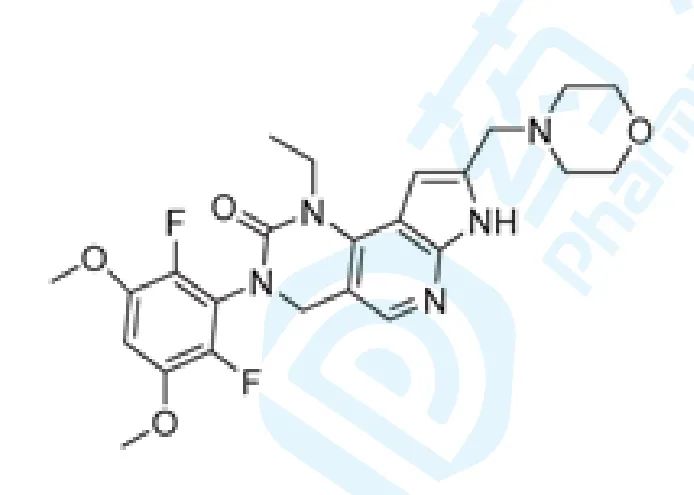
Pemigatinib由Incyte开发,于2018年3月被FDA认定为治疗胆管癌的孤儿药,并于2020年4月17日获得FDA加速批准上市,商品名为Pemazyre® ,用于局部晚期或转移性胆管癌的治疗 [6] 。
Pemigatinib是靶向于纤维细胞生长因子受体(FGFR)的小分子激酶抑制剂,能够抑制FGFR1、FGFR2、FGFR3的磷酸化和信号传导,并降低存在FGFR结构性激活的癌细胞的细胞活性。本品被批准用于既往接受过治疗的携带FGFR2融合突变(该基因的融合突变由FDA批准的测试方式检测)的不可切除局部晚期或转移性胆管癌成人患者 [7] 。FGFR2是多种肿瘤的潜在治疗靶点,FGFR2的融合突变常见于胆管癌,据报道,肝内胆管癌中有13%~20%的患者携带FGFR2融合突变 [8] 。
表4. Pemigatinib的同靶点上市药物
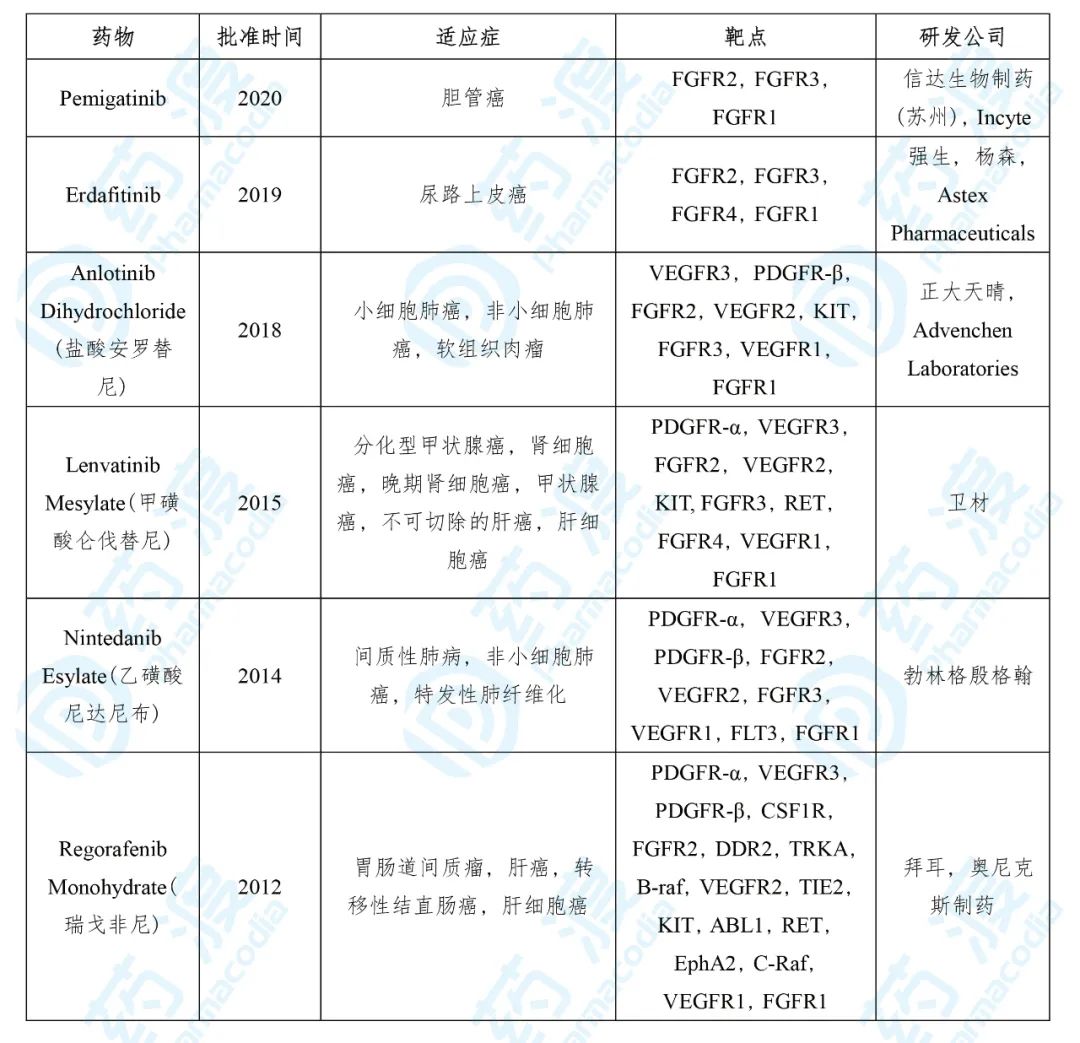
数据来源:药渡数据
Pemazyre® 的获批是基于一项针对局部晚期不可切除或转移性胆管癌患者的多中心开放性单臂实验,实验结果的客观缓解率(ORR)为36%,完全缓解率为2.8%;缓解持续时间中位数为9.1个月,超过6个月的比例为63%,超过12个月的比例为18% [7] 。
目前,除了被批准用于治疗胆管癌外,Pemigatinib针对淋巴细胞白血病、髓性白血病、泌尿生殖系统肿瘤的临床二期研究也正在进行当中。
4. Sacituzumab govitecan
Sacituzumabgovitecan由Immunomedics开发,并于2020年4月22日获得FDA批准上市,商品名为Trodelvy®,用于治疗三阴性乳腺癌[9]。
Sacituzumab govitecan是一种靶向于Trop-2的抗体偶联药物,由3部分组成:1)人源化IgG1 kappa型单克隆抗体Sacituzumab,靶向于Trop-2抗原(也称作上皮糖蛋白1,EGP-1);2)细胞**的小分子药物SN-38(伊立替康的活性代谢产物,7-乙基-10-羟基喜树碱),一种拓扑异构酶抑制剂,与拓扑异构酶I相互作用,防止其诱导的单链断裂的再连接;3)可裂解型Linker(名为CL2A),通过共价偶联将人源化单克隆抗体与SN-38连接起来 [10] 。Trop-2是人类细胞中的单拷贝基因,编码I型跨膜糖蛋白,在多种恶性肿瘤中都存在过度表达。它是近年发现的与肿瘤密切相关的基因,是一种可以调节肿瘤细胞生长的信号传导分子 [11] 。
表5. Sacituzumab govitecan的同靶点药物
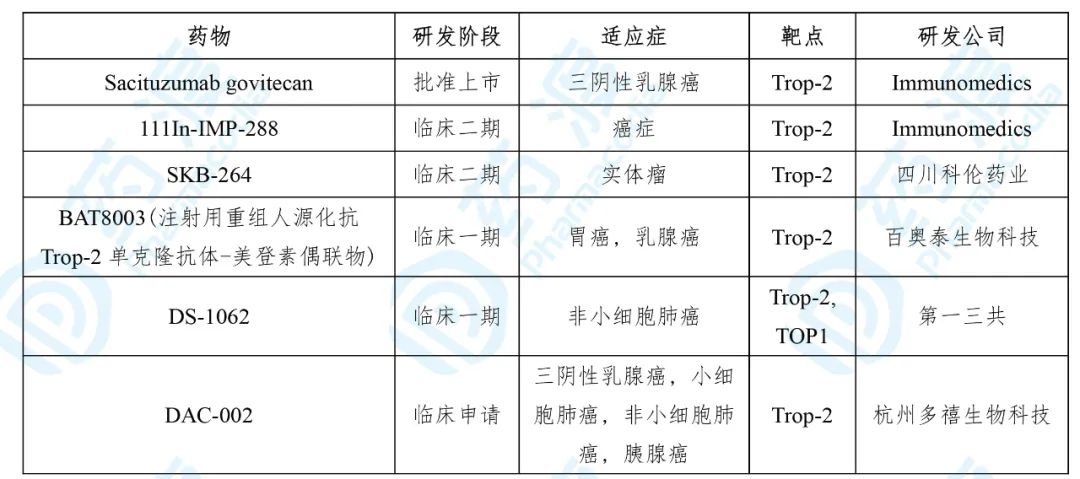
数据来源:药渡数据
Trodelvy® 的获批是基于一项针对转移三阴性乳腺癌患者的多中心单臂试验,试验共纳入108位至少接受过2次转移性治疗的患者。结果的客观缓解率为33.3%(24.6,43.1),完全缓解率为2.8%;缓解持续时间中位数为7.7(4.9,10.8)个月,超过6个月的比例为55.6%,超过12个月的比例为16.7% [10] 。
此前Sacituzumab govitecan分别获得了FDA授予的治疗小细胞肺癌、胰 腺癌以及EMA授予的治疗胰 腺癌的孤儿药地位。该药是首款获得FDA批准的靶向于Trop-2的抗体偶联药物,标志着肿瘤靶向治疗的发展又向前迈进了一步。
5. Coagulation factor VIIa (recombinant)-jncw
Coagulation factor VIIa (recombinant)-jncw由rEVO生物制药公司(LFB生物技术的子公司)研发,并于2020年4月1日获得FDA批准上市,由LFB Biotechnologies销售,商品名为Sevenfact® ,用于A型、B型血友病患者出血事件的控制与治疗 [12] 。
Coagulation factor VIIa (recombinant)-jncw是一种新型重组人凝血因子VIIa衍生物,在钙和磷存在的情况下,与组织因子(TF)形成复合体凝血因子VIIa,将凝血因子X活化为凝血因子Xa,直接绕过需要凝血因子VIII或IX的反应。凝血酶原被激活为凝血酶,随后凝血酶将纤维蛋白原转化为纤维蛋白形成止血栓,从而达到止血效果 [13] 。
表6. 近5年上市的Coagulationfactor VIIa (recombinant)-jncw同靶点药物
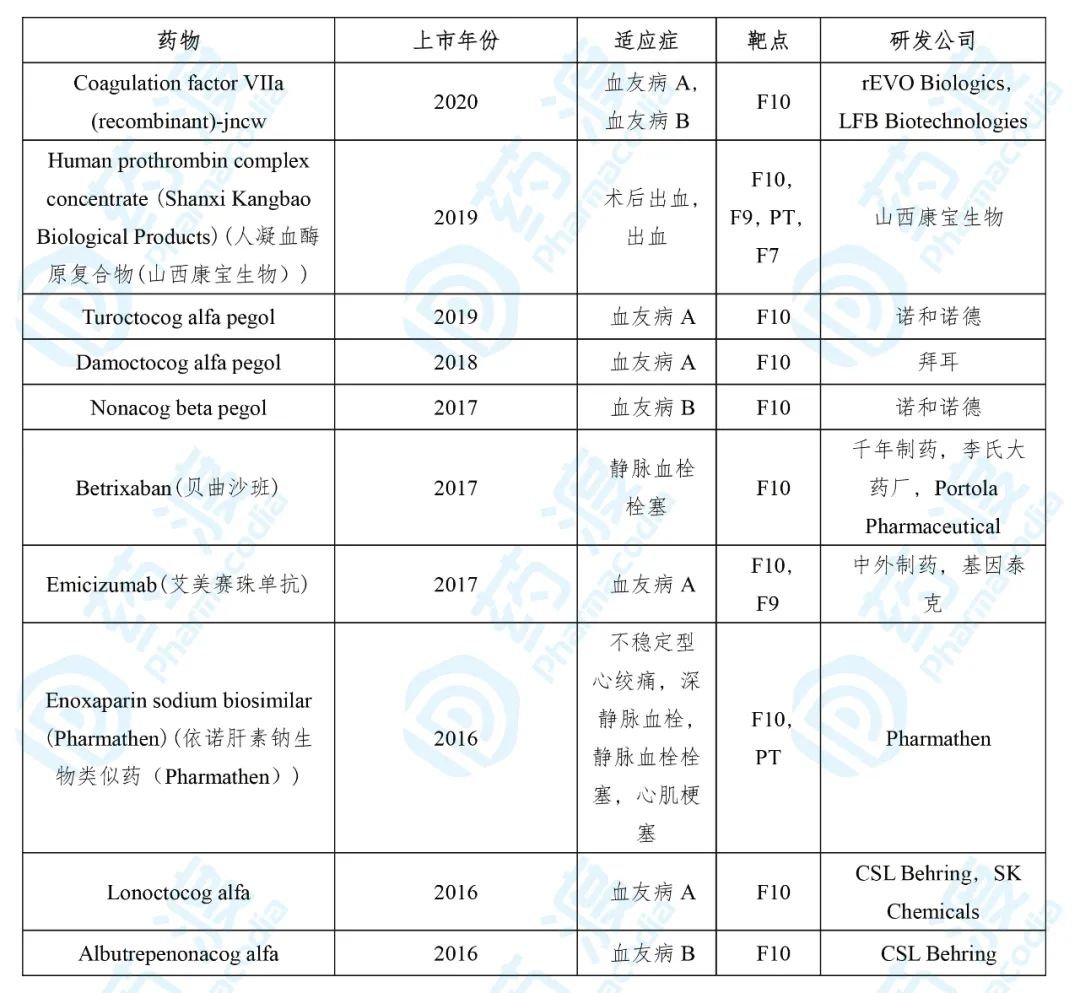
数据来源: 药渡数据
Sevenfact® 的批准是基于一项关键的三期临床试验数据,此次试验采用多中心交叉试验设计,对27名血友病A和B型患者的468次出血事件治疗效果进行了评估。结果两种初始剂量的治疗方案均在12小时内达到了出血控制的主要终点。采用225mcg/kg初始剂量治疗的轻、中度出血有91%在12小时内达到了止血效果,止血反应时间中位数为3h;初始剂量为75mcg/kg的止血反应时间中位数为6h,82%的出血事件在12小时内达到止血效果。24小时内,75mcg/kg治疗的止血率为97.6%,225mcg/kg治疗的止血率为99.5% [13] 。
近年来已经有多种治疗出血性疾病的方法可供选择,但目前还没有针对抑制剂相关性出血的新疗法,旁路药物仍然是一种重要治疗手段,而Sevenfact® 就是一种十分有效的旁路药物。
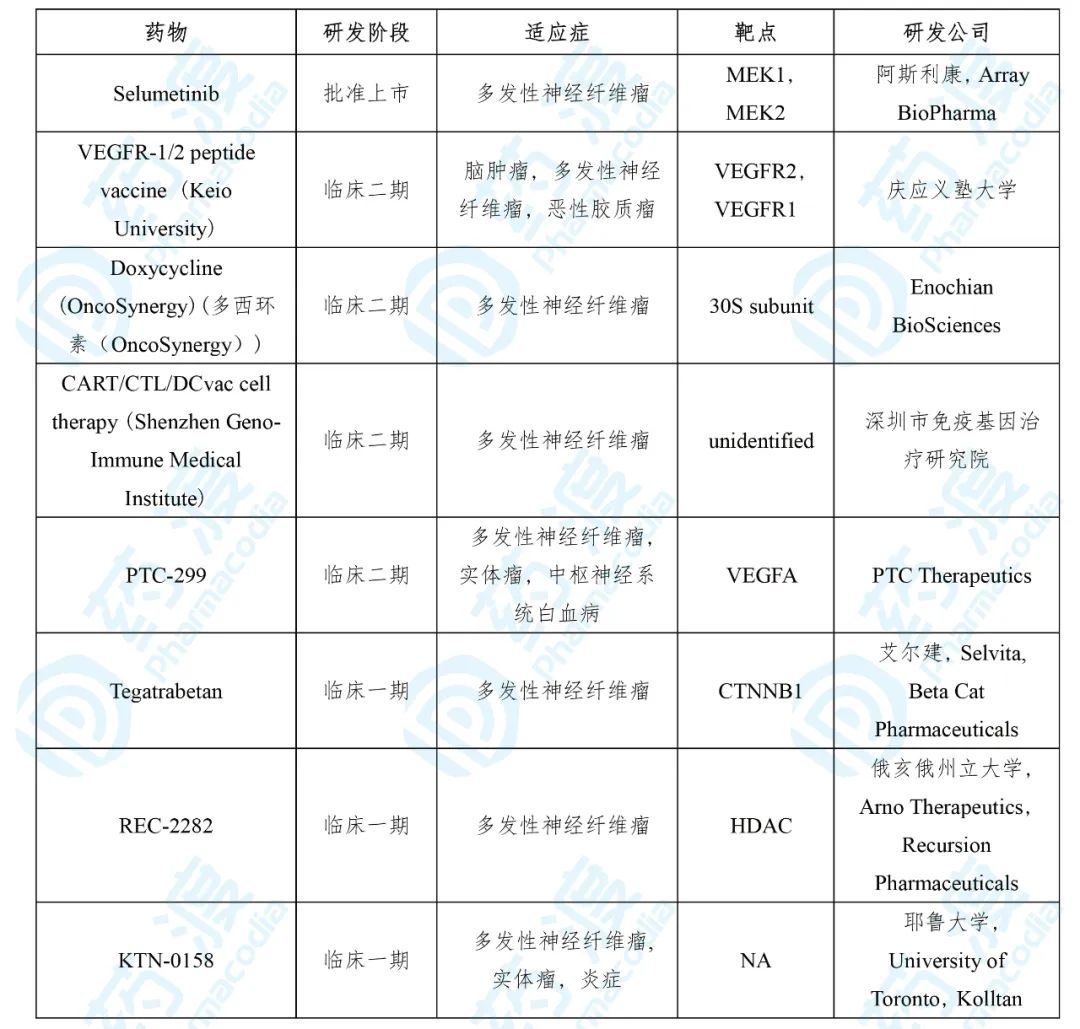
6. Prolgolimab
Prolgolimab由Biocad开发,于2020年4月获得俄罗斯卫生部批准上市,商品名为Forteca®。Prolgolimab是一种抗PD-1单克隆抗体,用于治疗无法切除或转移性黑色素瘤[14]。
黑色素瘤是一种从黑色素细胞发展而来的皮肤癌,根据全球癌症观察报告显示,皮肤黑色素瘤是全球第19大常见癌症,有近30万例新病例。且黑色素瘤的确诊通常会延后,有19%的患者会伴有晚期或转移性疾病 [15] 。
PD-1(也称为CD279),是一种重要的免疫抑制因子。PD-1与其配体PD-L1是近年来肿瘤免疫治疗的最大热门之一。药渡数据显示:目前全球针对PD-1/PD-L1靶点的在研药物共128个,其中针对PD-1的有77个,针对PD-L1的有58个;上市药物有11个,其中针对PD-1的有8个,针对PD-L1的有3个。
表7. 近5年上市的Prolgolimab同适应症药物

数据来源: 药渡数据
Forteca® 的获批是基于一项针对无法切除或转移性黑色素瘤患者的多中心开放性平行臂试验,试验采用每2周服用1mg/kg的prolgolimab或者每3周服用3mg/kg两种治疗方案,结果显示:每2周1mg/kg组12个月总生存率为74.6%,每3周3mg/kg组为54.0%;治疗相关不良事件(TRAEs)发生率分别为55.6%和54.0% [16] 。
参考文献
1. 药渡数据. https://data.pharmacodia.com/web/homePage/index(Selumetinib)
2. 柯屹峰, 郝瑞, 张虹. 1型神经纤维瘤病的基因学研究进展[J]. 中华实验眼科杂志, 2010,28(2):184-187.
3. FDA, Database. https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/213756s000lbl.pdf
4. 药渡数据. https://data.pharmacodia.com/web/homePage/index(Tucatinib)
5. FDA, Database.https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/213411s000lbl.pdf
6. 药渡数据. https://data.pharmacodia.com/web/homePage/index(Pemigatinib)
7. FDA, Database.https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/213736s000lbl.pdf
8. BGJ398治疗FGFR改变晚期胆管癌[J]. 实用肿瘤学杂志, 2017.
9. 药渡数据. https://data.pharmacodia.com/web/homePage/index(Sacituzumab govitecan)
10. FDA, Database.https://www.accessdata.fda.gov/drugsatfda_docs/label/2020/761115s000lbl.pdf
11. Trerotola M, Cantanelli P, Guerra E, et al. Upregulation of Trop-2 quantitatively stimulates human cancer growth [J]. Oncogene, 2012, 32(2).
12.药渡数据. https://data.pharmacodia.com/web/homePage/index(Coagulation factor VIIa (recombinant)-jncw)
13. FDA, Database. https://www.fda.gov/media/136610/download
14. 药渡数据. https://data.pharmacodia.com/web/homePage/index(Prolgolimab)
15. Novelanti-PD-1 drug was approved for melanoma treatment. https://www.eurekalert.org/pub_releases/2020-04/b-nad042720.php
16. Final Results of Phase II Trial (MIRACULUM) of the Novel PD-1 Inhibitor Prolgolimab in Patients with Advanced Melanoma. https://www.annalsofoncology.org/article/S0923-7534(20)34505-1/fulltext



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57