胃肠道间质瘤(gastrointestinal stromal tumor,GIST)
胃肠道间质瘤(gastrointestinal stromal tumor,GIST)是胃肠道最常见的间叶源性肿瘤,起源于 Cajal 间充质细胞(Interstitial Cells of Cajal,ICC),占软组织肉瘤的1/5。国外报道 GIST 的年发病率为百万分之七,国内报道 GIST 的年发病率为1.28/10万,虽然低于国外,但是随着对于 GIST 的认识不断加深及诊断技术的进步,发病率呈逐年上升趋势。
C-kit 基因突变及 PDGFRA 基因突变是 GIST 最常见的发病机制,没有检测到C-kit 及 PDGFRA 基因突变的 GIST 称为野生型 GIST。在 GIST 中 C-kit 基因突变占75%-80%、PDGFRA 基因突变占 5%-10%、野生型 GIST 占 10%-15%[1]。不同的基因突变类型与胃肠道间质瘤的临床病理特征、靶向治疗疗效及预后关系密切。C-kit 基因外显子9 突变类型胃肠道间质瘤多发生在小肠,对常规甲磺酸伊马替尼 400mg/日的治疗剂量不敏感。PDGFRA 基因 18 外显子 D842V 突变类型胃肠道间质瘤对现在已经上市的酪氨酸激酶抑制剂伊马替尼、舒尼替尼及瑞格菲尼均耐药。
GIST靶向治疗药物-经典
伊马替尼(Imatinib)
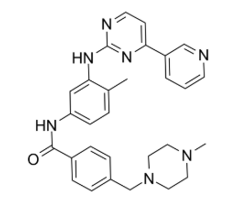
一代"神药"伊马替尼于2002 年成为第一个FDA批准用于不可手术和转移 GIST 的一线治疗药物。伊马替尼治疗晚期 GIST,80%的患者在治疗 2-3 个月后可以获得治疗反应,中位 OS 为 57-60 个月,约 50%的患者获得 5 年以上的生存期[2]。与其他基因突变类型相比,C-kit 外显子 11 突变对伊马替尼治疗最敏感,预后最好。C-kit 外显子 9 突变和野生型 GIST 伊马替尼疗效较差,但 9 号外显子突变可以从伊马替尼800mg/天的治疗中获益。约 10-15%的转移 GIST 对伊马替尼原发耐药,这类患者通常为 PDGFRA 外显子 18 D842V 突变或野生型 GIST。很大一部分伊马替尼初始治疗有效的转移 GIST 患者在 2-3 年内出现疾病进展,最常见的机制是由二次基因突变导致的继发耐药,二次突变常发生在激酶 ATP 结合部位和活化环(C-kit 外显子13、14、17 和 18)[3]。
舒尼替尼(Sunitinib)
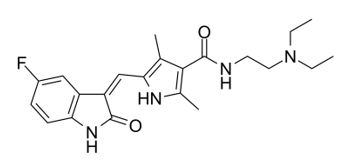
舒尼替尼是辉瑞公司开发的针对伊马替尼耐药的第二代胃肠间质瘤靶向治疗药物,具有吲哚酮结构,是一种针对KIT、PDGFR、VEGFR 及 FLT-1/KDR 的多靶点酪氨酸激酶抑制剂。在舒尼替尼(50mg/天,服药 4 周停药 2 周)对照安慰剂治疗伊马替尼治疗失败或不耐受的晚期 GIST Ⅲ期研究中,舒尼替尼组与安慰剂组相比,两组中位 TTP 分别为 27.3和 6.4 个月(HR 0.33,p<0.0001)。常见的副反应包括疲劳、腹泻、手足综合征及甲状腺功能减退,不良反应可以耐受。基于以上研究舒尼替尼被批准作为2 线药物治疗伊马替尼治疗失败或不耐受的晚期 GIST。
研究显示基因突变类型与舒尼替尼治疗反应有关,9 外显子和野生型受益更大,编码激酶 ATP 结合区的 13 或 14 外显子突变对舒尼替尼敏感,编码活化环的 17 或 18 外显子突变对舒尼替尼耐药[4]。
瑞戈非尼(Regorafenib)
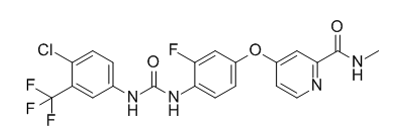
瑞戈非尼是BAYER公司继索拉菲尼以后开发的新一代口服多靶点酪氨酸激酶抑制剂,在2013年被批准用于治疗胃肠间质瘤。除了能够抑制KIT和PDGFRA激酶靶点以外,它还能作用于RET、BRAF、RAF1、VEGFR、FGFR、PDGFRP等靶点。瑞格菲尼针对伊马替尼或舒尼替尼治疗失败的晚期 GIST 的Ⅱ期研究显示出很好的效果,临床受益率(完全缓解、部分缓解、疾病稳定≥16 周)为 79%,中位 PFS 为 10 个月,最常见的 3 级**反应为高血压和手足综合征。以上Ⅱ期研究长期随访发现,瑞格菲尼对于 C-kit 11外显子突变 GIST 及 SDH 缺陷型 GIST 疗效显著。瑞格菲尼对照安慰剂的Ⅲ期研究发现,瑞格菲尼组中位 PFS 为 4.8 个月明显高于安慰剂组的 0.9 个月,但两组 OS没有明显差异。基于以上研究,瑞格菲尼被批准作为伊马替尼和舒尼替尼治疗失败或不耐受晚期 GIST 的三线治疗药物。
除上述三种靶向治疗药物以外,索拉菲尼、达沙替尼、尼洛替尼、帕唑替尼、卡博替尼等可作为GIST后线治疗的选择。
GIST靶向治疗药物-新贵
Ripretinib
2020年5月16日,再鼎医药合作伙伴Deciphera制药公司宣布,FDA提前3个月批准其广谱KIT和PDGFRα激酶抑制剂Ripretinib(Qinlock,DCC-2618)上市,成为第一个被批准专门用于四线治疗GIST的药物。Ripretinib适用于先前接受过3种或3种以上激酶抑制剂治疗的成人患者,包括:伊马替尼、舒尼替尼、瑞戈非尼等。
Ripretinib(DCC2618)是一种"开关控制"激酶抑制剂,它迫使活化环(或激活'开关')进入不活跃的构象。Ripretinib能抑制所有被检测的KIT和PDGFRA突变体,尤其是作为一种II型激酶抑制剂,它能广泛地抑制KIT和PDGFRA中的活化环突变,以往认为只有I型抑制剂才能实现[5]。
Ripretinib四线治疗GIST的关键III期INVICTUS(NCT03353753)研究显示,Ripretinib展现出非常显著的疗效优势,中位PFS达6.3个月,疾病进展或死亡风险下降85%,ORR 9.4%。而在既往的研究中,二线舒尼替尼治疗的ORR仅6.8%,中位PFS 6个月左右,三线瑞戈非尼的ORR仅4.5%,中位PFS仅4.8个月。Ripretinib作为四线及以上治疗的数据能与二三线治疗药物比美,还是令人惊艳的结果。此外,该研究中Ripretinib治疗有效的患者持续缓解时间很长。
目前,Ripretinib已写入最新的2020版NCCN指南推荐作为四线的标准治疗。国内,再鼎医药获得了Ripretinib在大中华区的开发权利,使得Ripretinib临床研究在中国快速推进,期待Ripretinib能早日在我国获批适应症,造福中国GIST患者。
avapritinib(BLU-285)
2020年1月9日,FDA宣布正式批准Blueprint Medicines公司开发的口服强效选择性的KIT 和 PDGFRα 抑制剂avapritinib用于治疗携带有血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可切除或转移性胃肠道间质瘤(GIST)的成人患者。
但是,2020年4月28日,Blueprint公布了Avapritinib与瑞戈非尼头对头试验(VOYAGER)最新数据,未能达其临床研究终点。此次公开的VOYAGER临床研究中,Avapritinib响应率高于瑞戈非尼(17% vs 7%),但mPFS反而弱于后者。这也提示GIST的机制复杂,尽管在PDGFRA外显子18突变的GIST中取得高达86%的总响应率ORR,但对于其他GIST则没能证明相对瑞戈非尼的改善。据此,FDA已拒绝了Avapritinib四线治疗GIST的NDA申请。Blueprint已经决定除已获批的适应症继续商业化之外,终止终止所有其他GIST适应症类型的临床研究。
国内,基石药业宣布,国家药品监督管理局(NMPA)已受理avapritinib的新药上市申请,包括两个适应症,分别为用于治疗携带血小板衍生生长因子受体α(PDGFRA)外显子18突变(包括PDGFRA D842V突变)的不可手术切除或转移性GIST成人患者,以及四线不可手术切除或转移性GIST成人患者。
目前基石药业开展的中国I/II期桥接研究的初步数据显示,中国GIST晚期患者的安全性及药代动力学特征数据均与NAVIGATOR全球研究数据一致,耐受性良好。
GIST靶向治疗药物-临床阶段药物
HQP1351
HQP1351由国内亚盛医药在研原创1类新药,为口服第三代BCR-ABL抑制剂,是国内首个三代BCR-ABL靶向耐药CML治疗药物,对BCR-ABL以及包括T315I突变在内的多种BCR-ABL突变体有突出效果。2019年7月,该品种获美国FDA临床试验许可,直接进入Ib期临床研究。今年5月,HQP1351接连获得美国FDA授予的孤儿药资格和审评快速通道资格。
今年6月18日,依据两项关键性注册临床研究结果,亚盛医药宣布向国家药品监督管理局(NMPA)新药审评中心(CDE)提交HQP1351的新药上市申请(NDA),用于治疗伴有T315I突变的慢性髓性白血病(CML)慢性期和加速期患者。
目前,HQP1351治疗伊马替尼原发耐药(PDGFRAD842V突变或NF1突变)或经过伊马替尼或伊马替尼和至少一种其它TKI治疗失败的GIST患者的临床I期试验正在进行当中。
Crenolanib
Crenolanib (CP-868596)是由Arog Pharmaceuticals公司开发的PDGFRA D842V 突变特异性抑制剂,并且可以减少 KIT/PDGFRA的表达。一项 II 期研究纳入 16 例 PDGFRA D842V 突变 GIST 患者,经 Crenolanib治疗后临床获益率为 31%(2 例 PR,3 例 SD)[6]。目前,Crenolanib治疗GIST的三期临床试验NCT02847429正在入组,预计2020年8月完成入组。
Masitinib
Masitinib 作为主要针对 KIT、PDGFRα/β 及 FGFR 的多靶点激酶抑制剂,在体外实验中表现比伊马替尼更高的对 KIT 的活性和选择性。Masitinib 一线治疗晚期 GIST 的研究中,中位 PFS 为 41 个月,在安全性和疗效上与伊马替尼相当[7]。其早期和舒尼替尼做了一个2期小样本研究,该研究主要研究终点是OS。Masitinib的2期临床研究OS可达到29.8个月,但其PFS仅有3.7个月。在2012年开始,进行了Masitinib和舒尼替尼的2线3期临床研究(NCT01694277),主要研究终点为5年OS,该研究目前正在进行中。
结语
未来,GIST治疗将迈入以驱动基因为基础的精准治疗时代,相信会有更多克服耐药性的靶向新药涌现出来,为GIST患者带来临床获益。
参考文献
1. Nat Rev Cancer, 2011,11(12):865-878
2. J Clin Oncol, 2008,26(4):620-625
3. F1000Res, 2017,6:1689.
4. J Clin Oncol, 2008,26(33):5352-5359.
5. Cancer Cell. 2019,13;35(5):738-751.
6. Expert Rev Anticancer Ther, 2017,17(12):1117-1129.
7. Ann Oncol, 2014,25(9):1762-1769.



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57