近日(2月22日),阿斯利康官方宣布,主动要求撤销Imfinzi (Durvalumab)在美国针对既往接受过治疗的局部晚期或转移性膀胱癌(尿路上皮癌)适应症,该决定已经与美国食品药品管理局(FDA)进行协商并确定。值得注意的是,此次适应症的撤销并不影响Imfinzi在美国以外其他地区膀胱癌及非小细胞肺癌适应症批准情况。
膀胱癌是常见的泌尿系统恶性肿瘤,位列全球常见恶性肿瘤第九位,位列中国男性常见恶性肿瘤第七位。其中尿路上皮癌(也称移行细胞癌)是主要的组织学类型,占所有膀胱癌的90%,因此膀胱癌又称为膀胱尿路上皮癌。根据治疗模式及疾病预后的不同,膀胱癌可表现为非肌层浸润癌、肌层浸润癌和转移性癌。对于早期非转移性膀胱癌一般以手术治疗为主,对于晚期转移性膀胱癌患者则以化疗、免疫治疗等全身治疗方案为主。转移性膀胱尿路上皮癌一线治疗以含顺铂化疗为主,化疗方案包括吉西他滨+顺铂、DD-MVAC(G-CSF支持),不可耐受顺铂患者可选吉西他滨+卡铂或免疫治疗(阿特利珠单抗、帕博利珠单抗);以PD-1/L1单抗为主的免疫治疗较传统化疗显著改善了晚期尿路上皮癌的二线治疗客观缓解率,目前转移性膀胱尿路上皮癌二线治疗优先考虑免疫治疗,FDA批准药物包括帕博利珠单抗(KEYNOTE045,化疗对照三期,ORR 21.1%)、阿特利珠单抗(IMvigor210,单臂二期,ORR 15.0%)、纳武利尤单抗(CheckMate275,单臂二期,ORR 24.4%)、Durvalumab(Study 1108,单臂I/II期,ORR 17%)及阿维鲁单抗(JAVELIN,单臂III期,ORR 16.1%)。
Imfinzi作为阿斯利康抗PD-L1抗体药物,除了此次美国撤销的膀胱癌适应症之外,其他已获批适应症主要集中在肺癌领域,包括在67个国家(包括中国)获批用于治疗同步放化疗后未进展的不可切除III期非小细胞肺癌(NSCLC),以及在51个国家获批联合依托泊苷和铂类化疗一线治疗广泛期小细胞肺癌(ES-SCLC)。此次撤销的膀胱癌适应症,曾在18个国家获批。根据阿斯利康2020年年报数据显示,Imfinzi作为公司第三大重磅药物,2020年营收20.42亿美元,营收主要来自非小细胞肺癌适应症。
2017年5月,Imfinzi基于一项I / II期临床试验Study 1108研究(NCT01693562)中尿路上皮癌队列显著的肿瘤客观缓解率(ORR)和肿瘤缓解持续时间(DOR),获得含铂化疗期间或化疗后疾病进展或在含铂新辅助化疗或辅助化疗12个月内疾病进展的局部晚期或转移性尿路上皮癌(二线)适应症。Study 1108研究是一项多中心、多队列、单臂I / II期临床研究,旨在评估Imfinzi在多个晚期实体瘤中的安全性和有效性,其中局部晚期或转移性尿路上皮癌队列受试者182例。虽为I / II期研究,但凭借其较传统化疗显著改善的肿瘤客观缓解率(ORR 17%,传统二线化疗平均ORR 12%),获得FDA有条件快速审批。适应症的继续批准取决于上市后晚期一线膀胱癌DANUBE III期临床试验的结果,该研究在2020年未达到其主要终点。
Study 1108研究尿路上皮癌队列疗效结果
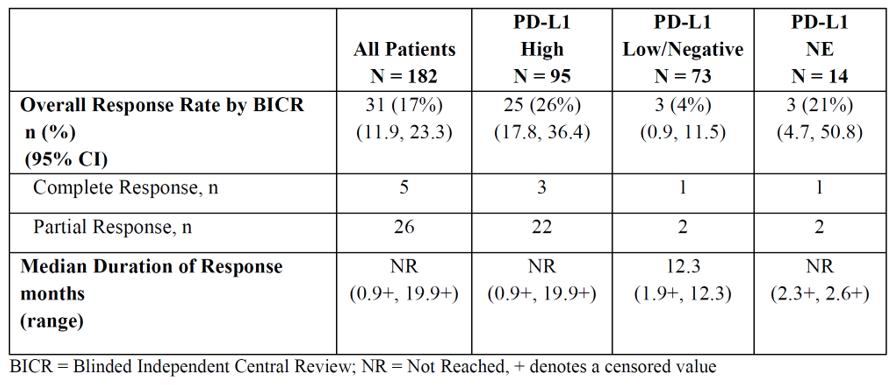
出自参考来源5
DANUBE(NCT02516241)是一项随机、对照、开放、多中心III期临床研究,旨在评估Durvalumab单药或Durvalumab联合Tremelimumab(抗CTLA-4抗体)对比标准含铂化疗(吉西他滨/顺铂或吉西他滨/卡铂),一线治疗不可切除的局部晚期或转移性尿路上皮癌的有效性与安全性。研究共纳入1032例受试者,1:1:1随机入组,分层因素包括是否可耐受顺铂、PD-L1状态、是否有肝/肺转移。此研究主要终点为双终点,分别为通过评价总生存期(OS)评价在PD-L1阳性人群中Durvalumab单药组相较标准化疗组的有效性;以及通过评价总生存期(OS)评价在总研究人群(ITT)中Durvalumab联合Tremelimumab组相较标准化疗组的有效性。
研究结果显示,双研究终点均未达到。截止至数据统计时间,中位随访时间为41.2个月。在PD-L1阳性人群中,Durvalumab单药组中位OS为14.4 个月(95% CI 10.4-17.3)相较标准化疗组中位OS 12.1 个月 (10.4-15.0)未达统计学显著性差异(HR 0.89, 95% CI 0.71-1.11; p=0.30)。在ITT人群中,Durvalumab联合Tremelimumab组中位OS 15.1个月(13.1-18.0)相较标准化疗组中位OS 12.1个月亦未达到统计学假设(HR 0.85, 95% CI 0.72-1.02; p=0.075)。安全性方面Durvalumab单药组或联合组均与之前报道一致。
DANUBE主要研究终点OS- Durvalumab单药组VS. 化疗组
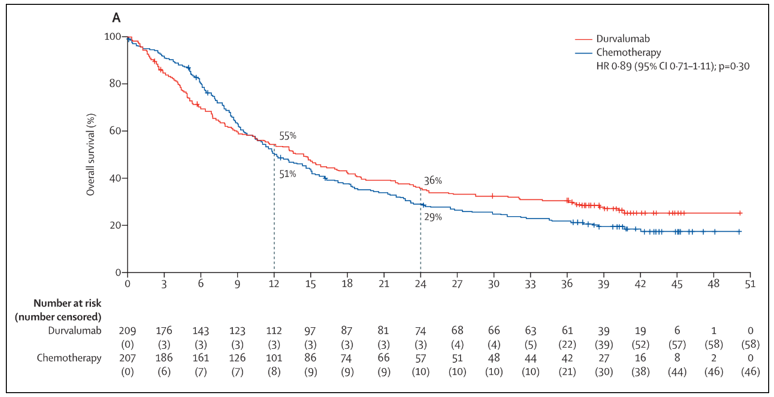
出自参考来源2
DANUBE主要研究终点OS- Durvaluma联合组VS. 化疗组
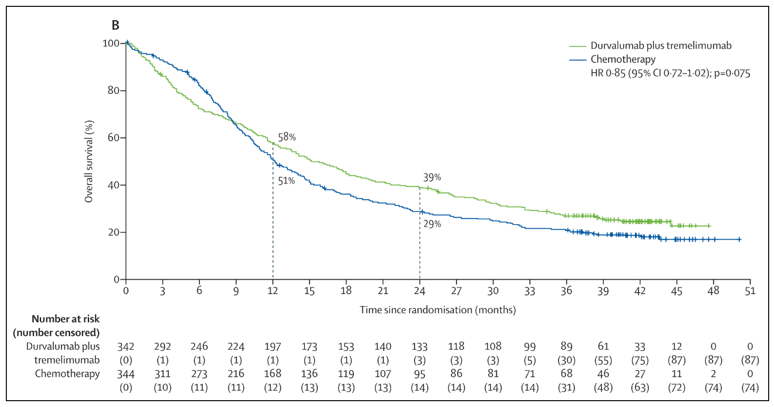
出自参考来源2
尽管DANUBE III期研究未达主要终点,但对免疫在膀胱癌后续的研发起到警醒作用。未来如何筛选出真正能从一线免疫治疗单药或免疫联合方案中获益的膀胱癌患者?以及何种免疫联合方案最有效?都需要更多的思考和探索。同时阿斯利康公司表示将继续Imfinzi在膀胱癌的相关临床研究。
阿斯利康正在开展的Imfinzi 相关III期膀胱癌临床研究
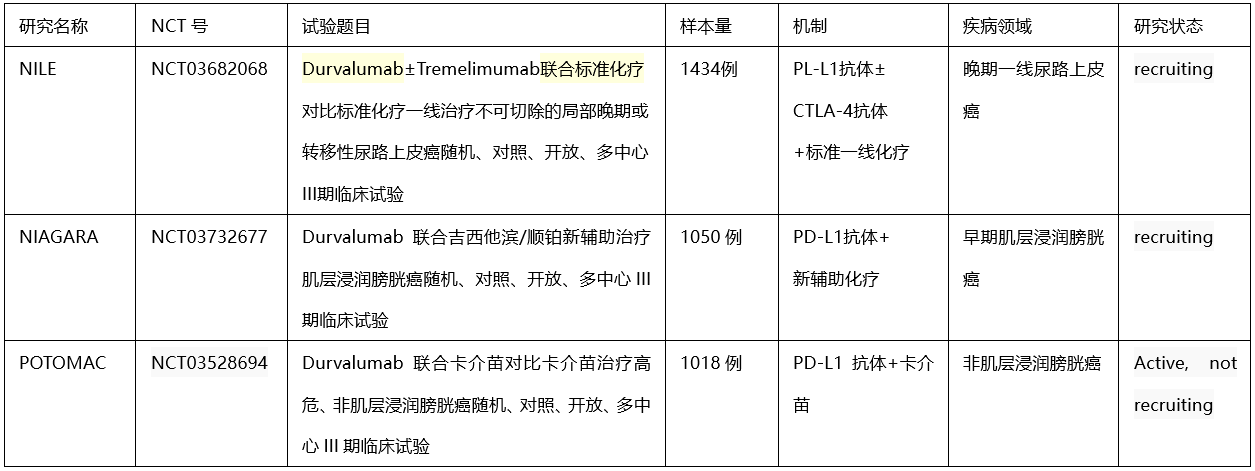
参考来源:
1. Voluntary withdrawal of Imfinzi indication in advanced bladder cancer in the US. News release. AstraZeneca.
2. Powles TB, van der Heijden MS, Castellano Guana D, et al. A phase III, randomized, open-label study of first-line durvalumab (D) with or without tremelimumab (T) vs standard of care chemotherapy in patients with unresectable, locally advanced or metastatic urothelial carcinoma (DANUBE). Annals of Oncology. 2020;31(suppl_4):S550-S550.
3. Update on Phase III DANUBE trial for Imfinzi and tremelimumab in unresectable, Stage IV bladder cancer. News release. AstraZeneca. Published March 6, 2020.
4.阿斯利康2020年财报
5. Durvalumab FDA 官网https://www.accessdata.fda.gov/scripts/cder/daf/index.cfm?event=BasicSearch.process
6. https://clinicaltrials.gov
7.CSCO尿路上皮癌诊疗指南2020版



合作咨询
![]() 肖女士
肖女士
![]() 021-33392297
021-33392297
![]() Kelly.Xiao@imsinoexpo.com
Kelly.Xiao@imsinoexpo.com
 2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57
2006-2025 上海博华国际展览有限公司版权所有(保留一切权利)
沪ICP备05034851号-57